消化在线: 曲美他嗪介导内皮祖细胞修复冠心病血管
来源:
曲美他嗪介导内皮祖细胞修复冠心病血管损伤的机制研究
立题依据
冠心病是我国常见的心血管疾病之一,严重危害人们的健康和生活。我国是世界人口最多的国家,随着人口老龄化的不断发展,导致冠心病发病率明显增加,已成为我国城市及农村人口死亡的重要原因,而国家在防治冠心病方面投入的资金也逐年巨额增加。因此,如何有效的防治冠心病,降低冠心病相关的死亡率,已成为我国重大疾病防治的主要任务之一,对于我国社会经济发展具有重要的临床应用价值。
血管内皮结构和功能损伤是冠心病血管病变的始动环节,并加重和促进冠心病血管病变的进展和恶化。因此,修复血管内皮损伤是有效防治冠心病血管病变的重要措施。传统观点认为血管内皮损伤的修复主要依赖于损伤部位邻近正常内皮细胞的迁移和生长增殖,但是邻近的内皮细胞属于成熟终末分化细胞,其迁移增殖能力弱,难以快速再内皮化修复损伤内皮层。近来研究发现,骨髓和外周血中存在内皮细胞的前体细胞—内皮祖细胞(Endothelial progenitor cells, EPCs),是修复血管内皮损伤的重要细胞生物学基础[1, 2]。在血管内皮损伤后,内皮祖细胞从骨髓中被动员释放至外周血循环,通过在损伤血管局部的迁移和生长增殖,加快损伤血管再内皮化,在血管内皮损伤修复过程中起着重要作用[2]。临床研究证实在心血管危险因素存在的情况下,循环内皮祖细胞的数量和功能下降,并且与血管内皮功能受损有关[3]。在既往的研究中,我们探讨了生理性衰老血管功能的变化与循环内皮祖细胞关系,结果发现生理性衰老存在血管内皮依赖舒张功能减弱,而且这种血管功能障碍与循环内皮祖细胞数量减少密切相关,提示循环内皮祖细胞数量减少导致的内源性血管修复能力下降是生理性衰老血管损伤的发病机制之一[4,5]。在进一步的研究中,我们还发现,通过切应力和运动等多种方法调节内皮祖细胞功能基因和蛋白表达,增加内皮祖细胞数量和功能,能加快损伤血管再内皮化,改善血管内皮功能,表明内皮祖细胞是血管内皮损伤修复的重要靶点[6-10]。
研究表明,在冠心病情况下存在内皮祖细胞数量和功能受损,降低了内源性血管损伤修复能力,这与冠心病血管病变的发生发展密切相关[2, 3]。冠心病患者内皮祖细胞的数量明显减少,增殖和迁移功能受损,凋亡速度加快,血管损伤后再内皮化能力减弱[2, 3]。所以,内皮祖细胞的数量及功能下降是冠心病血管内皮损伤的重要细胞生物学机制。
血管生成素(Angiopoietin, Ang)及其胞膜酪氨酸激酶受体(Tyrosine kinase with immunoglobulin and epidermal growth factor homology domain-2, Tie2) 是调节内皮祖细胞功能活性的重要细胞信号分子。研究表明,Ang1 或Ang2与Tie2受体结合后,能明显增加内皮祖细胞的体外迁移和增殖活性,加速体外血管形成,促进内皮祖细胞介导的体内血管新生 [11,12]。在刚刚完成的国家自然科学基金资助项目《切应力调控内皮祖细胞Tie2信号通路修复血管损伤的研究》和广东省自然科学基金资助项目《切应力调控内皮祖细胞归巢功能修复血管损伤的研究》研究中,我们进一步发现切应力可以通过上调内皮祖细胞Tie2信号通路,促进Akt/eNOS磷酸化,增加NO分泌,改善内皮祖细胞再内皮化能力,有利于在体血管损伤后修复 [9]。因此,Tie2信号通路是介导内皮祖细胞动员、迁移和增殖功能并加快血管损伤后修复的重要途径。通过上调内皮祖细胞Tie2表达,提高内皮祖细胞功能活性,增强其修复血管内皮损伤能力,是以细胞疗法为基础防治血管损伤的重要方法。
曲美他嗪(Trimetazidine) 是具有独特改善心肌代谢及抗心肌缺血缺氧作用的药物,对冠心病和慢性心衰有良好的治疗效果[13,14]。近来研究进一步发现,曲美他嗪能明显增加内皮依赖的舒张反应性,改善血管内皮功能[15]。此外,还有报道在糖尿病动物模型,曲美他嗪能修复颈动脉血管损伤,加速血管再内皮化[16]。所以,曲美他嗪改善血管内皮功能是其心血管保护作用的重要机制之一。但是,有关曲美他嗪改善血管内皮功能的具体机制目前尚不清楚。有研究发现,曲美他嗪能改善eNOS活性,增加NO分泌,这可能与其心血管保护作用有关[17]。我们的近期研究已证实,Tie2信号通路能通过促进Akt/eNOS磷酸化,增加NO分泌,调节内皮祖细胞动员、迁移和增殖功能并加快血管损伤后修复[9] 。所以,我们推测曲美他嗪可能通过Tie2/PI3K /Akt/eNOS途径增强内皮祖细胞功能,加快冠心病血管内皮损伤修复。因此,在以往的研究工作基础上,我们拟从体外细胞培养模型、血管损伤修复模型和临床研究模型三个方面,探讨曲美他嗪调控内皮祖细胞Tie2信号通路提高其动员、迁移和增殖功能的可能机制,及其介导修复冠心病血管损伤的可能作用,这对于以细胞疗法防治冠心病血管病变具有重要的意义。国内外尚未见类似研究。参考文献:
(1)Kumar AH, Caplice NM. Clinical potential of adult vascular progenitor cells. Arterioscler Thromb Vasc Biol 2010; 30: 1080-1087.
(2)Lamping K. Endothelial progenitor cells: sowing the seeds for vascular repair. Cir Res 2007;100:1243-1245.
(3)Hill, JM, Zalos G, Halcox JP, et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. New Engl J Med 2003; 348: 593–600.
(4)Tao J, Wang Y, Yang Z, et al. Circulating endothelial progenitor cell deficiency contributes to impaired arterial elasticity in persons of advancing age. J Hum Hypertens 2006;20:490-495.
(5)Tao J, Tu C, Yang Z, et al. Circulating progenitor cells deficiency contributes to impaired endothelium function in humans with aging. Circulation 2004; 110(Suppl): 20.
(6)Yang Z, Tao J, Wang JM, et al. Shear stress contributes to t-PA mRNA expression in human endothelial progenitor cells and nonthrombogenic potential of small diameter artificial vessels. Biochem Biophys Res Commun 2006; 342: 577-584.
(7)Yang Z, Wang JM, Wang LC, et al. In vitro shear stress modulates antithrombogenic potentials of human endothelial progenitor cells. J Thromb Thromboly 2007; 23:121-127.
(8)Yang Z, Wang JM, Chen L, et al. Acute exercise-induced nitric oxide production contributes to upregulation of circulating endothelial progenitor cells in healthy
subjects. J Hum Hypertens 2007; 21: 452-460.
(9) Yang Z, Xia WH, Zhang YY, et al. Shear stress-induced activation of Tie2-dependent
signaling pathway enhances in vivo reendothelialization capacity of human endothelial progenitor cells. J Mol Cell Cardiol 2012; 52(5):1155-63.
(10) Yang Z, Xia WH, Su C, et al. Regular exercise-induced upregulation of circulating endothelial progenitor cells attenuated age-related decline in arterial elasticity in healthy men. Int J Cardiol 2011 online available Sep 26.
(11) Kim KL, Shin IS, Kim JM, et al. Interaction between Tie receptors modulates angiogenic activity of angiopoietin2 in endothelial progenitor cells. Cardiovasc Res 2006; 72: 394–402.
(12) Kim KL, Shin IS, Kim JM, et al. Angiopoietin-2 stimulates migration of endothelial progenitors and their interaction with endothelium. Biochem Biophys Res Commun 2005; 336: 392–396.
(13) Horowitz JD, Chirkov YY, Kennedy JA, et al. Modulation of myocardial metabolism: an emerging therapeutic principle. Curr Opin Cardiol 2010;25(4):329-34.
(14) Di Napoli P, Taccardi AA. Trimetazidine: the future of cardiac function? Future Cardiol2009;5(5):421-4.
(15) Belardinelli R, Solenghi M, Volpe L, et al. Trimetazidine improves endothelial dysfunction in chronic heart failure: an antioxidant effect. Eur Heart J 2007;28(9):1102-8.
(16) Yoon JW, Cho BJ, Park HS, et al. Differential effects of trimetazidine on vascular smooth muscle cell and endothelial cell in response to carotid artery balloon injury in diabetic rats. Int J Cardiol 2012 Jan 10.
(17) Di Napoli P, Chierchia S, Taccardi AA, et al. Trimetazidine improves post-ischemic recovery by preserving endothelial nitric oxide synthase expression in isolated working rat hearts. Nitric Oxide 2007;16(2):228-36.
拟解决的关键问题
1. 分析Tie2信号通路在曲美他嗪调控内皮祖细胞功能活性中的作用
2. 探讨曲美他嗪介导内皮祖细胞修复冠心病血管损伤的作用
研究目标与研究内容
1. 研究目标
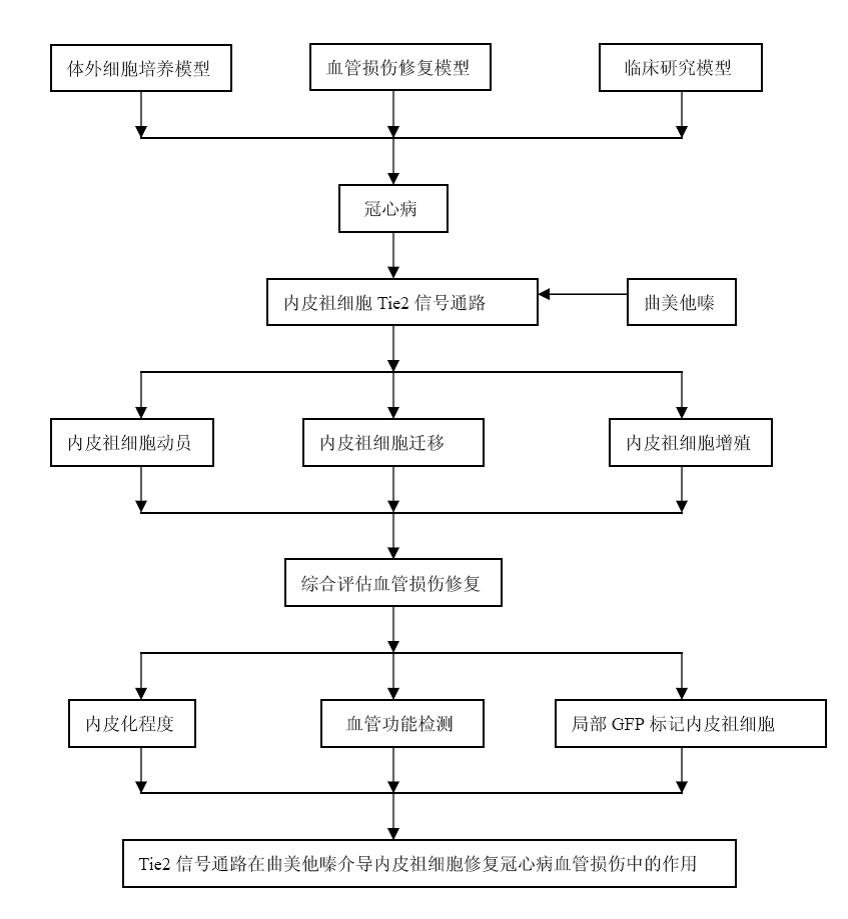
本研究拟从体外细胞培养模型、血管损伤修复模型和临床研究模型三个方面,探讨曲美他嗪调控内皮祖细胞Tie2信号通路提高其动员、迁移和增殖功能的可能机制,及其介导修复冠心病血管损伤的可能作用,为曲美他嗪介导内皮祖细胞修复冠心病血管损伤提供分子生物学的理论依据。
2. 研究内容
2.1 采用曲美他嗪体外处理冠心病患者内皮祖细胞,观察曲美他嗪对冠心病内皮祖细胞Tie2信号通路的调控机制。
2.2 通过RNA干扰技术和特异性抑制剂阻断Tie2信号通路,分析曲美他嗪调控内皮祖细胞Tie2信号通路对功能活性的影响。
2.3 应用RNA干扰沉默内皮祖细胞Tie2基因,将内皮祖细胞经曲美他嗪处理后移植至裸鼠血管损伤模型,观察血管损伤局部的修复情况。
2.4 观察曲美他嗪治疗前后冠心病患者内皮祖细胞Tie2信号通路水平和修复血管损伤能力变化与血管内皮功能指标变化的关系,探讨Tie2信号通路在曲美他嗪介导内皮祖细胞修复冠心病血管损伤中的作用。
研究方案
1. 研究方法
1.1内皮祖细胞的体外分离、培养、鉴定和标记
采用Ficoll离心法分离出冠心病患者外周血单个核细胞,并诱导分化成内皮祖细胞。细胞培养一周后取部分贴壁细胞在一定浓度ac—LDL溶液中孵育1小时,之后20 mL/L多聚甲醛固定,以一定浓度lectin 抗体溶液孵育1小时,并置于荧光显微镜下观察拍片,红色和绿色双染色细胞为内皮祖细胞。另一部分贴壁细胞加入VWF和FLK-1免疫荧光抗体一抗孵育30分钟,再加入二抗孵育30分钟,绿色染色细胞为内皮祖细胞。之后用GFP基因转染标记大鼠外周血内皮祖细胞并检测转染阳性率。
1.2 特异性阻断内皮祖细胞Tie2信号通路
RNA干扰沉默Tie2基因: 应用Genbank 获得Tie2的基因序列,从中选择和设计合适的序列,合成针对Tie2 基因的siRNA,通过蔓病毒载体系统转染至内皮祖细胞内,采用RT-PCR检测RNA干扰沉默内皮祖细胞Tie2基因表达的效果。同时,应用Western-blotting 技术检测内皮祖细胞Tie2的蛋白表达。
内皮祖细胞PI3K/Akt/eNOS信号传导通路的阻断:采用 PI3K抑制剂 LY294002 (LY)、Akt 抑制剂 MK2206 和eNOS抑制剂 L-NAME预处理24小时。
1.3 分析曲美他嗪对内皮祖细胞Tie2信号通路的调控机制
采用不同浓度曲美他嗪(0, 0.1, 1, 10和100μmol/L)体外处理内皮祖细胞,采用RT-PCR和Western-blotting方法检测内皮祖细胞Tie2信号通路各分子表达的变化。选择作用最显著的曲美他嗪浓度,按上述处理阻断内皮祖细胞Tie2信号通路后,分为6组:Tie2 siRNA+曲美他嗪组、LY+曲美他嗪组、MK2206+曲美他嗪组、L-NAME+曲美他嗪组、曲美他嗪组,对照组。对照组不予任何干预措施。观察内皮祖细胞上述Tie2信号通路分子的表达。
1.4 观察曲美他嗪调控内皮祖细胞Tie2信号通路对功能活性的影响
按上述方法阻断内皮祖细胞Tie2信号通路并予以曲美他嗪处理后,测定内皮祖细胞的体外迁移和增殖功能。
1.5探讨Tie2信号通路在曲美他嗪介导内皮祖细胞促血管损伤修复中的作用
RNA干扰沉默内皮祖细胞的Tie2基因,将内皮祖细胞经曲美他嗪处理后移植至裸鼠血管损伤模型,分为4 组:Tie2 siRNA+曲美他嗪组、曲美他嗪组、对照组和PBS组,对照组不予任何干预措施,PBS组采用无菌PBS注射。在移植后3d、1w和2w处死动物,每个时间点样品6个。通过病理学和分子生物学方法观察裸鼠血管内皮损伤的修复情况,检测GFP标记内皮祖细胞在局部的聚集情况,分析局部血管组织Tie2的基因和蛋白表达。
1.6 研究曲美他嗪临床治疗对冠心病患者内皮祖细胞Tie2通路与血管功能的影响
本研究拟招募慢性稳定型心绞痛患者60例和年龄匹配的正常健康志愿者30例,所有入选志愿者通过询问病史、详细的体格检查和实验室检查,排除糖尿病、恶性肿瘤、严重心功能不全、感染或炎症性疾病。所有入选冠心病患者均通过冠脉造影检查确诊为冠心病。其中,30例冠心病患者随机分至常规治疗组,应用冠心病常规治疗,包括硝酸酯类药物、他汀类药物、?受体阻滞剂、钙离子拮抗剂和抗血小板药物。另外30例冠心病患者随机分至曲美他嗪组,在冠心病常规治疗的基础上加服曲美他嗪20 mg(万爽力,法国施维雅公司),每日三次,疗程6个月。两组患者采取平行对照双盲研究。30例年龄匹配的正常健康志愿者作为对照组。检测患者外周血内皮祖细胞Tie2信号通路水平、体外功能及修复血管损伤能力。同时,用血管功能检测仪测量患者脉搏波传导速度(Pulse wave velocity, PWV)、增强指数(Augment index, AI)、以及动脉弹性C1和C2,用血管超声检测内皮依赖性血管舒张功能(Flow-mediated dilation, FMD)和颈动脉内-中膜厚度(Intima-media thickness, IMT),综合评估患者的血管功能指标。比较对照组和两组冠心病患者治疗前后外周血内皮祖细胞Tie2信号通路水平、体外功能及修复血管损伤能力和血管功能指标,分析曲美他嗪治疗前后高血压患者内皮祖细胞Tie2信号通路水平变化与其体外功能和修复血管损伤能力变化的关系,及其与血管内皮功能指标变化的关系。
2. 技术路线
杨震