消化在线: 万爽力调节心肌能量代谢及抑制心肌肥厚
来源:
万爽力调节心肌能量代谢及抑制心肌肥厚的作用及机制研究
立题依据
课题的提出和意义:
心肌肥厚是心脏对许多外来刺激如:高血压、瓣膜性心脏病、心肌梗死和心肌病等的一种反应。虽然这个过程是对心脏增加作功的一种代偿,但长期如此会导致心力衰竭、心律失常和猝死。心力衰竭是心肌肥厚最常见的并发症,是一种心脏收缩功能不全而无法满足机体代谢需要的复杂的综合征,它是当今人类主要死因之一。虽然目前心脏移植是终末期心衰的最有效治疗方法,但这种治疗并非每个病人可以获得,它也不适合于轻度病变的病人。目前药物治疗心衰主要通过改变神经内分泌(如:β受体阻滞剂和ACEI类药)以提高心脏收缩功能或纠正心肌细胞钙转运实现。虽然这些方案可以使心功能短期升高,但心衰的5年死亡率仍然接近50%。因此需要寻找新的治疗方法,具用重要意义。本项目就是针对万爽力的新作用,抑制心肌肥厚及其作用机制提出的。
本项目是以相关研究万爽力(曲美他嗪)可抑制心肌肥厚,原有研究过氧化物酶体增殖物激活受体(PPARα)在调节心肌细胞能量代谢及抑制心肌肥厚中起重要作用为研究基础,通过苯肾上腺素诱导原代培养的心肌细胞肥大及主动脉缩窄诱导大鼠心肌肥厚,观察万爽力干预后心肌细胞PPARα表达、心肌能量代谢和肥大的变化以及SiRNA技术阻断PPARα通路后,心肌能量代谢和肥大变化,以了解PPARα在万爽力调节心肌能量代谢及心肌肥厚中的作用。这对进一步阐明万爽力抑制心肌肥厚的作用机制,及推广应用具有重要意义。
有关心肌肥厚的形成机制:
心肌肥厚的特征是心肌细胞体积增大、蛋白质合成增加及肌纤维增多。目前关于心肌肥厚的发生机制尚不十分清楚,其发生的分子机制研究众多,主要有:1、神经钙蛋白-NFAT信号通路。2、PI3K/AKT/GSK-3依赖信号通路。3、MEF2/HPAC对心肌肥大的转录调控。4、G蛋白复合受体的肥大信号通路。5、小G蛋白与肌原纤维信号通路。6、MAPK信号通路。7、PKC信号通路。8、GP130/STAT3信号通路。9、脂质代谢障碍机制。10、MMP/TNF机制等。然而关于肥大心肌细胞研究的重要发现是肥大心肌出现胚胎心脏的特征改变,即:出现胚胎基因再激活,肥大心肌脂肪酸氧化能力下降,能量主要来源由脂肪酸向糖转变。有几个事实却支持这种底物利用在心肌肥厚的病理形成中起重要作用。如:线粒体内脂肪酸氧化酶缺陷是少年肥厚心肌病的原因;有报道在心肌肥厚发生前有几种糖酵解酶活性增加;乙莫克舍,一种肉毒碱棕榈转移酶I不可逆抑制剂,抑制脂肪酸β氧化,因出现心肌肥厚而在临床被终止使用。由此可见,心肌细胞能量代谢障碍是导致心肌肥大的重要原因,探讨改善心肌细胞方法及机制,对寻找治疗心肌肥大的新方法具有重要意义。
万爽力与心肌能量代谢及肥厚的关系研究
万爽力,其活性成份为盐酸曲美他嗪。曲美他嗪(trimetazidine,TMZ)是一种哌嗪类衍生物,作为一种改善心肌能量代谢的药物,近年来,受到人们的广泛关注。TMZ通过抑制长链3-酮酰辅酶A-硫解酶(3-KAT),抑制游离脂肪酸代谢,促进葡萄糖代谢和有氧氧化,将心肌的能量代谢由脂肪酸氧化向葡萄糖氧化转移,改善心肌的能量代谢,而不对血流动力学产生任何影响,不产生正/负性肌力作用。研究者在控制血压、抑制心室重构基础上加用曲美他嗪辅助治疗,经连续服用3个月后发现观察组有效率明显高于对照组, 心功能分级及左室射血分数改变明显优于对照组, 证实曲美他嗪辅助治疗高血压性心脏病慢性心衰患者效果确切。其机制可能与曲美他嗪具有对抗肾上腺素、去甲肾上腺素及加压素的作用,能降低血管阻力,增加冠脉血流量及周围循环血流量,促进心肌代谢及心肌能量的产生。同时能减低心脏工作负荷。降低心肌耗氧量及心肌能量的消耗,从而改善心肌氧的供需平衡。有研究通过建立异丙肾上腺素诱导大鼠心肌肥厚模型,观察曲美他嗪不同干预时机对心肌肥厚的影响。 该研究观察和评价曲美他嗪预处理对大鼠肥厚心脏的保护作用,并探讨其中可能的机制。其结果显示: 1.曲美他嗪预处理可以明显改善肥厚心肌再灌注期间的血流动力学,减少再灌注时心肌酶释放,增加NO合成,减少FT的释放,保护肥厚心肌。 2.曲美他嗪预处理可以减少再灌注期间脂质过氧化,清除氧自由基,减轻心肌线粒体损伤,明显保护再灌注期间线粒体呼吸功能;同时减轻心肌细胞凋亡,是减轻肥厚心肌再灌注损伤的一个重要机制。魏春燕等对曲美他嗪干预异丙肾上腺素诱导的大鼠心肌肥厚研究结果显示曲美他嗪可明显减轻异丙肾上腺素所致的心肌细胞坏死、心肌肥厚,减少心肌细胞凋亡。
心肌肥厚过程中心肌相对供血供氧下降,加重心肌缺血、缺氧。左室肥厚形成过程实际上就是左室重构过程。心肌缺血引起心肌组织相对或绝对供血、供氧不足,导致缺血组织中ATP快速耗竭,抑制了依赖ATP活性的Na+-K+泵,使细胞内Na+增多,而心肌组织代谢产物堆积和线粒体内NADH2的氧化受抑制,[H+]不断增多,[H+]增多促进Na+-H+交换,以维持正常PH值。同时,Na+增加也导致Na+-Ca+离子交换增加,引起Ca+浓度增加。缺氧还引起局部浸润的中性粒细胞和线粒体产生自由基,高[Ca+]和自由基抑制细胞功能,造成细胞结构受损。心肌缺血通常还伴有随后的再灌注损伤。
心肌缺血主要是一种代谢性事件。心肌缺血缺氧可发生心肌代谢重构,包括体内脂肪酸氧化减少,而葡萄糖氧化增加。心肌PCr降低,心肌能量贮备指数PCr/ATP比值降低,线粒体氧化呼吸功能下降,线粒体膜电位改变。TMZ减轻线粒体内Ca+聚积,在细胞水平提供心肌保护作用和对肥厚心肌的抗细胞凋亡作用。TMZ还可减轻缺血心肌的酸中毒和炎症反应,减少心肌内钙超负荷,从而在一定程度上阻断了Ca+/Calcineulin通路介导的心肌肥厚。TMZ通过提高线粒体内谷胱甘肽、SOD及谷胱甘肽过氧化物酶活性,以增强其抗氧化能力。曲美他嗪通过以上作用机制,降低心肌肥厚程度。另有研究显示细胞凋亡参与了心肌重构。其中线粒体参与了细胞凋亡过程,并起开关作用。心肌细胞富含线粒体,他对ATP合成与细胞内Ca+浓度维持起重要作用。曲美他嗪通过抑制Ca+超载,减轻线粒体肿胀。曲美他嗪通过对线粒体能量代谢优化,使心肌耗氧得以更经济的利用,一定程度上抑制了因能量代谢障碍诱导的细胞凋亡,从而起到心肌细胞的保护作用。
以上研究表明曲美他嗪有抑制心肌肥厚作用。我们在前期实验中发现用PE诱导的大鼠心肌细胞肥大,过氧化物酶体增殖物激活受体s(PPARs)mRNA和蛋白表达下降,PPARγ作为心肌能量重要调节物,很可能参与曲美他嗪对心肌能量的调节及影响心肌肥厚。由此我们推测PPARγ信号通路,可能参与曲美他嗪对心肌肥厚能量调节,并拟对其进行深入研究
PPARs与心肌能量代谢及肥厚的关系研究:
过氧化物酶体增殖物激活受体(PPARs)是与维甲酸、类固醇和甲状腺激素受体相关的配体激活转录因子超家族核激素受体成员。它们作为脂肪传感器调节脂肪代谢酶的转录。PPARs由PPARα、PPARδ/β和PPARγ3种亚型组成。PPARα主要在脂肪酸代谢水平高的组织,如:肝、棕色脂肪、心、肾和骨骼肌表达。PPARδ/β广泛表达于各种组织,而PPARγ主要局限表达在血和棕色脂肪,其他组织如骨骼肌和心肌有少量表达。PPARs通常是通过与9-cis维甲酸受体(RXR)结合实现其转录活性的。最近报道认为PPARα在心脏病中起重要作用,在心肌肥厚生长时出现底物利用由脂肪酸向糖转变是和PPARα失活有关。PPARα-/-小鼠的心、肝与脂肪酸转运(FATP,FAT/CD36,FABP,ACS, M-CPT-I/CPT-Iβ)和氧化(MCAD,LCAD,VLCAD)有关的酶和蛋白的构成较同龄小鼠显著降低。在PPARα-/-乳鼠心肌细胞培养介质内,加入活化PPARα的配体不能增加上述酶的表达。这一变化与减少心肌摄入长链脂肪酸和随之的长链脂肪酸氧化能力下调相一致。此外,在自发性高血压心衰小鼠模型中, PPARα的表达减少到胚胎水平。另外,PPARα基因影响人左心室对运动和高血压反应性增生的事实表明心脏底物利用的不适应是左心室心肌肥厚病理形成的原因之一。这些结果也说明这种转录因子活性的下降可以解释参与脂肪酸氧化酶的下调。对PPARδ/β的研究认为,它和PPARα在心肌细胞有关脂肪酸代谢中享有相似作用。最近对PPARγ的研究发现,PPARγ活性下降在心肌肥厚形成中也起重要作用。利用PPARγ激活剂在体内外可抑制心肌肥大,PPARγ缺陷小鼠在压力负荷下,心肌肥厚较野生鼠更明显。
综上所述,PPARs是介导心肌肥厚能量代谢底物转变的重要介质之一。PPARs在心肌肥厚及心力衰竭的病理生理机制具有重要作用。
有关曲美他嗪与PPARα的关系研究:
曲美他嗪可通过心肌能量代谢的调节而调节心肌肥厚进展,PPARα是介导心肌肥厚能量代谢底物转变的重要介质之一。 PPARα信号通路有可能是介导曲美他嗪调节心肌肥厚的作用机制之一,目前尚未见有关报道。
有关曲美他嗪、PPARα、能量代谢与心肌肥厚关系问题的解决:
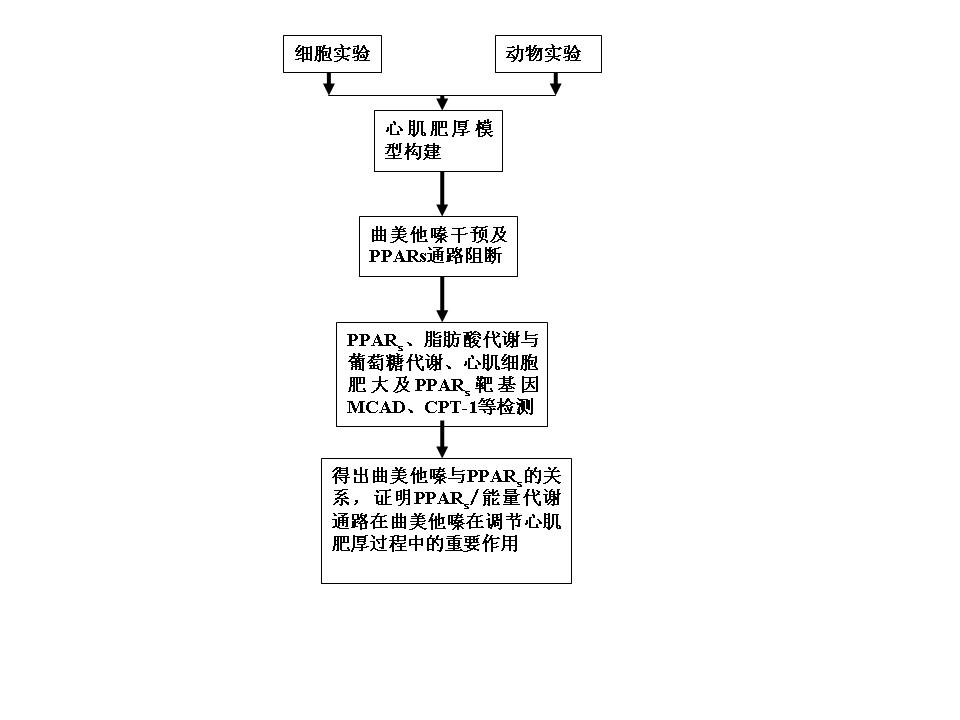
根据以上所提的问题,我们设想利用PE诱导培养的心肌细胞肥大和主动脉缩窄来构建心肌肥厚模型,观察曲美他嗪干预PE诱导心肌肥大和主动脉缩窄来构建心肌肥厚后PPARα及能量代谢的变化。利用SiRNA技术阻断PPARα通路后,观察曲美他嗪对PE诱导的心肌细胞肥大及脂肪酸、葡萄糖代谢影响,从而探讨出曲美他嗪与PPARα的关系,阐明曲美他嗪对心肌肥厚及能量代谢调节,以及PPARα信号通路在曲美他嗪抑制心肌肥厚形成过程中的作用。
结束语
本项目主要是进行曲美他嗪抑制心肌肥厚及其作用机制研究,选择PPARα作为曲美他嗪调节心肌细胞能量代谢及肥厚作为研究着手点,通过主动脉缩窄诱导心肌肥厚和PE诱导培养心肌细胞肥大来构建心肌肥厚实验模型,利用SiRNA技术、RT-PCR、Western blot等技术手段,检测PPARα、能量代谢的变化与心肌肥厚的相关关系,证明PPARα在介导曲美他嗪调节心肌能量代谢及抑制心肌肥厚中的重要作用。有关这一研究,未见有报道。这一研究的证明,对推广曲美他嗪的应用具有重要意义,希望能得到支持和资助。
课题意义
本项目的特色是探讨曲美他嗪对能量代谢及心肌肥厚的影响。创新之处: PPARα作为心肌细胞能量关键调节因子之一,它们与曲美他嗪关系尚不清楚,目前未见有关报道,它们之间的确切关系尚需进一步研究。对他们的相关性研究,有利于寻找曲美他嗪的新作用。
拟解决的关键问题
1、通过动物实验和培养心肌细胞肥大模型构建,利用曲美他嗪干预,观察曲美他嗪对PPARα、能量代谢及肥大细胞的影响,以及通过SiRNA技术阻断PPARα通路,观察阻断PPARα通路后曲美他嗪对能量代谢及细胞肥大的影响。证明PPARα在介导曲美他嗪调节心肌细胞能量及心肌肥厚中的作用。
2、心肌细胞能量代谢指标检测:脂肪酸与葡萄糖代谢可利用同位素液闪烁方法检测,中山大学核医学科有液闪烁仪可以保证完成。
参考文献
1.Planavila A, Calvo RR, Vazquez-Carrera M. Peroxisome proliferator-activated receptors and the control of fatty
acid oxidation in cardiac hypertrophy. Mini Rev Med Chem. 2006;6(3):357-363.
2.Sugden PH & Clerk A. Cellular mechanisms of cardiac hypertrophy. J Mol Med. 1998;76(11):725–746.
3.Frey N, Olson EN. Cardiac hypertrophy: the good, the bad, and the ugly. Annu Rev Physiol. 2006;65:45-79.
4.Kelly DP, Strauss AW. Inherited cardiomyopathies. N Engl J Med. 1994 ;330(13):913-919.
5.Anderson RC, Balestra M, Bell PA, et al. Antidiabetic agents: a new class of reversible carnitine palmitoyltransferase I inhibitors. J Med Chem. 2005;38(18):3448-3450.
6.Arad M, Moskowitz I, Patel V, et al. Transgenic mice overexpressing mutant PRKAG2 define the cause of Wolff-Parkinson-White syndrome in glycogen storage cardiomyopathy. Circulation. 2003; 107(22): 2850-2856.
7.P.J. Smeets, B.E. Teunissen, P.H. Willemsen, et al. Cardiac hypertrophy is enhanced in PPAR{alpha}-/- mice in response to chronic pressure overload. Cardiovasc Res 2008.
8.Barger PM, Kelly DP. PPAR signaling in the control of cardiac energy metabolism. Trends Cardiovasc Med. 2007 ;10(6):238-245.
9.Jamshidi, Y; Montgomery, H.E; Hense, H.W; et al. Peroxisome proliferator--activated receptor alpha gene regulates left ventricular growth in response to exercise and hypertension. Circulation.2005;105(8):950-955.
10.Gilde, A.J; van der Lee, K.A.J.M; et al. Peroxisome proliferator-activated receptor (PPAR) alpha and PPARbeta/delta, but not PPARgamma, modulate the expression of genes involved in cardiac lipid metabolism. Circ Res. 2006;92(5):518-524.
11.Asakawa, M; Takano, H; Nagai, T; et al. Peroxisome proliferator-activated receptor gamma plays a critical role in inhibition of cardiac hypertrophy in vitro and in vivo. Circulation. 2002;105(10):1240-1246.
12.Barger PM, Brandt JM, Leone TC,et al. Deactivation of peroxisome proliferator-activated receptor-alpha during cardiac hypertrophic growth. J Clin Invest. 2007; 105(12): 1723-1730.
研究目标与研究内容
研究目标
通过细胞与动物实验心肌肥厚模型构建,利用SiRNA技术阻断PPARα通路,观察曲美他嗪对PPARα、能量代谢及心肌肥厚的影响以及阻断PPARα通路后曲美他嗪对能量代谢及心肌肥厚的影响。从而阐明曲美他嗪与PPARα的关系以及证明PPARα/能量代谢通路在曲美他嗪调节心肌肥厚形成过程中的重要作用,为寻找曲美他嗪新作用提供依据。
研究内容
1、利用PE诱导心肌细胞肥大构建心肌肥厚模型,检测心肌肥大指标:细胞面积和3H亮氨酸掺入率,以明确实验模型成功。
2、利用曲美他嗪干预,检测其对诱导的肥大心肌细胞PPARα、能量代谢及肥大细胞的影响。
a)RT-PCR,Western blot检测PPARα以及MCAD、CPT-I的mRNA与蛋白表达。
b)细胞能量代谢检测:脂肪酸与葡萄糖代谢间接方法通过RT-PCR、Western blot检测MCAD和CPT-I的mRNA及蛋白表达来表示,直接方法参照Karin和Luque等介绍的方法进行。
c)细胞脂肪酸沉积率测定:脂肪酸沉积率通过以下公式计算:
脂肪酸沉积率=细胞内14C放射量/(细胞内14C放射量+收集二氧化碳14C放射量)×100%
d)心肌细胞肥大指标检测:通过图像分析测细胞面积和液闪烁法测3H亮氨酸掺入率表示。
e)利用SiRNA技术阻断PPARα通路,观察曲美他嗪在PPARs通路阻断后心肌细胞肥大及脂肪酸、葡萄糖代谢的变化。
3、 利用Western blot、Northen和免疫共沉淀方法,检测ERK1/2和P38在曲美他嗪调节PPARα中的作用,进一步阐明曲美他嗪调节PPARα机制。
4、利用主动脉缩窄术构建压力负荷诱导的大鼠心肌肥厚,长期曲美他嗪处理实验鼠,观察曲美他嗪长期使用对心肌肥厚、PPARα及能量代谢影响。
a) 利用主动脉缩窄术构建压力负荷诱导的大鼠心肌肥厚模型。
b)长期(8W)曲美他嗪干预。
c)检测对照组、模型组与实验组的PPARs及其靶基因MCAD、CPT-1等表达,及ERK1/2和P38;细胞能量代谢,心肌肥厚指标。
研究对象
SD大鼠
研究方法
1、心肌细胞肥大模型构建,利用PE诱导心肌细胞肥大,参照Barger PM等方案进行。
2、曲美他嗪干预。
3、通过图像分析测细胞面积及同位素3H亮氨酸掺入率了解心肌细胞肥大情况,同位素3H亮氨酸掺入率参照我们以前做法进行。
4、通过Northen及Western blot检测PPARα以了解曲美他嗪对PPARα的影响及作用水平。
5、用SiRNA技术阻断PPARα通路,观察曲美他嗪在PPARα通路被阻断后对心肌细胞肥大及脂肪酸、葡萄糖代谢的影响。SiRNA技术参照本课题组成员过去进行过的方法进行(详见成员介绍)。
6、脂肪酸与葡萄糖代谢间接方法通过RT-PCR、Western blot检测MCAD和CPT-I的mRNA及蛋白表达表示,直接方法参照Karin.和Luque等介绍的方法进行。
7、Northen及Western blot检测P38和ERK1/2mRNA及蛋白表达,并通过siRNA方法阻断P38和ERK1/2,观察阻断P38和ERK1/2后,曲美他嗪对PPARs的影响。阐明P38和ERK1/2通路在曲美他嗪调节PPARs中的作用。
8、脂肪酸沉积率通过以下公式计算:
脂肪酸沉积率=细胞内14C放射量/(细胞内14C放射量+收集二氧化碳14C放射量)×100%
9、利用主动脉缩窄术构建压力负荷诱导的大鼠心肌肥厚模型,参照以前做法进行[9]。
10、实验分对照组、假手术组、模型组和实验组。
11、曲美他嗪处理8周后,处死动物,按以上方法或相关参考文献检测心肌肥厚;脂肪酸与葡萄糖代谢; PPARs、MCAD、CPT-I、ERK1/2和P38蛋白及mRNA表达。
12、统计学分析:所有数据采用SPSS11.0统计软件进行分析。
技术路线
本课题主要是进行曲美他嗪调节心肌能量代谢及心肌肥厚的作用研究, PPARα/能量代谢通路为研究切入点,利用主动脉结扎、细胞培养、SiRNA技术、RT-PCR、Western blot、IP等技术,对PPARα、ERK1/2和P38的mRNA及蛋白表达,葡萄糖、脂肪酸代谢,与心肌肥大指标的分析,以期阐明PPARα在介导曲美他嗪调节能量代谢及心肌肥厚过程中的重要作用,为曲美他嗪寻找新的作用提供依据。
技术路线图
赵雅红