消化在线: 曲美他嗪对心肌缺血再灌注损伤诱导
来源:
曲美他嗪对心肌缺血再灌注损伤诱导的中性粒细胞胞外核酸网形成和冠脉无复流的影响及干预研究
立论依据
心肌梗死是目前全世界范围内致死致残的主要原因之一[1],而临床上主要是通过经皮冠状动脉介入(percutaneous coronary intervention, PCI)治疗的方法来及时并有效恢复缺血心肌血流供应,从而达到挽救心肌的目的。然而,再灌注过程中出现的心律失常、心肌顿抑、微血管损伤以及不可逆的细胞损伤却进一步加重了缺血对心肌的损伤[2,3],这种现象称为缺血再灌注(ischemia-reperfusion, I/R)损伤。缺血再灌注损伤的出现降低了再灌注疗法的心肌获益。对于再灌注损伤机制的研究有利于从根本上找到提高心肌存活率的方法,进而缩小心肌梗死范围。目前研究认为,氧化应激、中性粒细胞介导的炎症反应,细胞凋亡,钙离子超载,免疫系统反应都参与了这一病理过程[4,5]。
心梗后损伤区域有特征性的炎症反应。中性粒细胞早期浸润,24h-48h达高峰,随后由单核细胞取代。有研究证实去除循环中的中性粒细胞能减少心梗面积[6-8]。中性粒细胞是机体防御入侵微生物病原体的一线细胞,在固有免疫中发挥重要作用[9]。在炎症刺激下,中性粒细胞迅速从血液中迁移至感染组织,在组织中结合并吞噬细菌,被吞噬的细菌被中性粒细胞内蛋白水解酶类、抗菌蛋白和活性氧杀灭。中性粒细胞也可以通过释放抗菌颗粒蛋白到细胞外基质的方式来杀灭病原微生物,即脱颗粒作用。中性粒细胞胞外核酸网(neutrophil extracellular traps, NETs)的形成是近年来发现的中性粒细胞继吞噬和脱颗粒作用后发挥抗菌功能的新方式[10]。目前对于NETs结构和形成的研究认为,NETs主要是由细胞染色质,核组蛋白,多种中性粒颗粒内的抗菌蛋白以及一些胞质蛋白组成,形成于感染和非感染疾病的脉管系统中,而DNA酶或者抗组蛋白抗体可以削弱NETs的抗菌能力[9]。因其形成过程有别于凋亡和坏死,在体内中性粒细胞这种新型死亡方式被Steinberg 等最先命名为NETosis[11]。
在NETs形成过程中,中性粒细胞的核膜和胞质内的颗粒膜都会发生破裂,但浆膜的完整性会被维持直至最终碎裂释放出NETs,这就为具有抗菌功能的颗粒内蛋白和胞核内解聚染色质的相互混合提供了条件,最终形成了含有丰富抗菌蛋白的核酸网[12,13](图1)。近期Massberg等发现中性粒细胞的主要抗菌效应成分丝氨酸蛋白酶和外化的核小体一起可以起到促凝的作用,在体内没有病原体刺激的条件下即可以促进血管内血栓形成[14]。之后Fuchs等在进一步观察中发现释放的细胞外核酸网可以刺激血小板的粘附和聚集并为血栓形成提供支架。同时NETs还可以聚集红细胞,促进纤维蛋白沉积,诱导红色血栓的形成[15]。这项发现揭示了在无菌性炎症中NETs的产生与血栓形成的密切关系。 而且Alexander等发现NETs的形成与缺血再灌注损伤密切相关[4]。
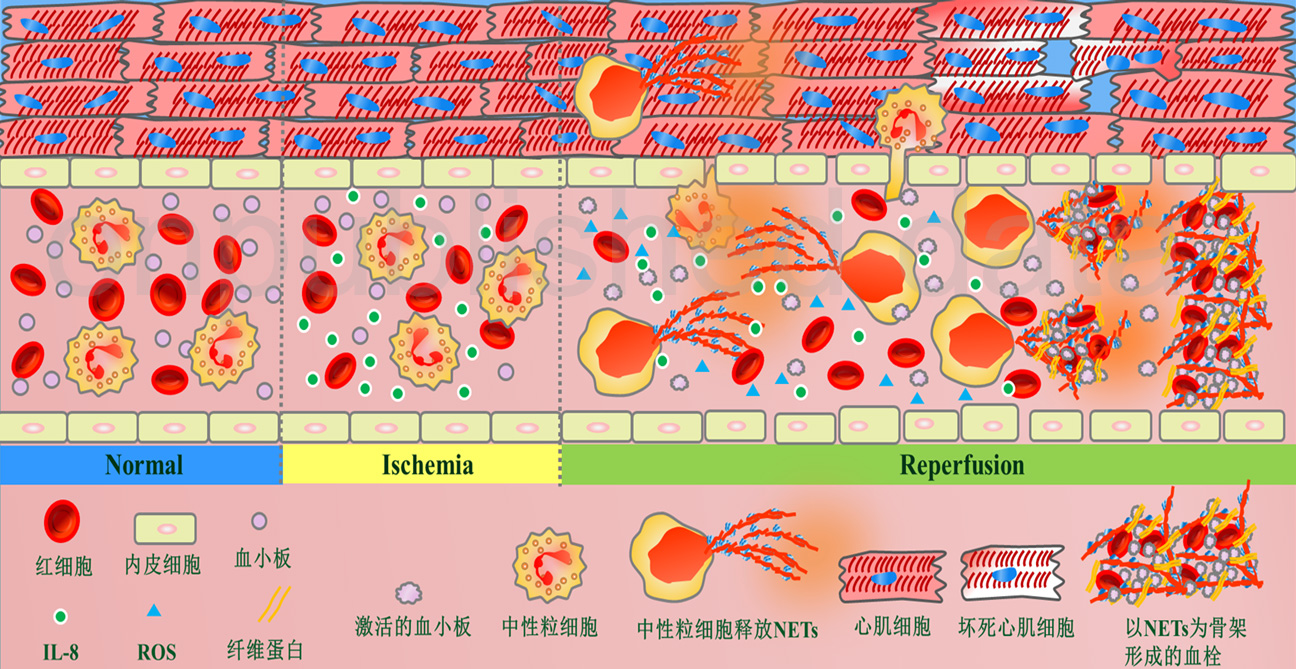
图1:缺血再灌注损伤诱导NETs的形成机制。正常状态下循环内存在一定数量的中性粒细胞。缺血缺氧时内皮细胞及中性粒细胞释放大量IL-8。再灌注后大量中性粒细胞迅速募集至缺血心肌,在IL-8以及ROS的作用下生成NETs。除了NETs本身对内皮细胞的损伤作用以外,激活的血小板以及红细胞通过直接或间接的方式同NETs紧密粘附,并且纤维蛋白在NETs的刺激下沉积于NETs的骨架结构上,形成以NETs为核心的新型血栓。血栓形成使再灌注血流无法顺利进入微循环,造成心肌坏死。
心肌缺血再灌注时微循环水平发生复杂的代谢变化。缺氧条件下的内皮细胞可以释放与时间成正比量的IL-8[16],而IL-8是已知的可以刺激激活的中性粒细胞生成NETs的有效物质[9]。同时再灌注过程中形成的大量的活性氧类物质也是NETs形成的必需条件[17]。而微循环内血流的低流速也有利于NETs保持结构稳定。在前期工作中我们发现在发生缺血再灌注的心肌微循环内有NETs的产生(图2),联合使用DNase和rt-PA减少NETs产生能够减低心肌梗死的面积,提高心肌复流比例,进而改善远期心脏功能。
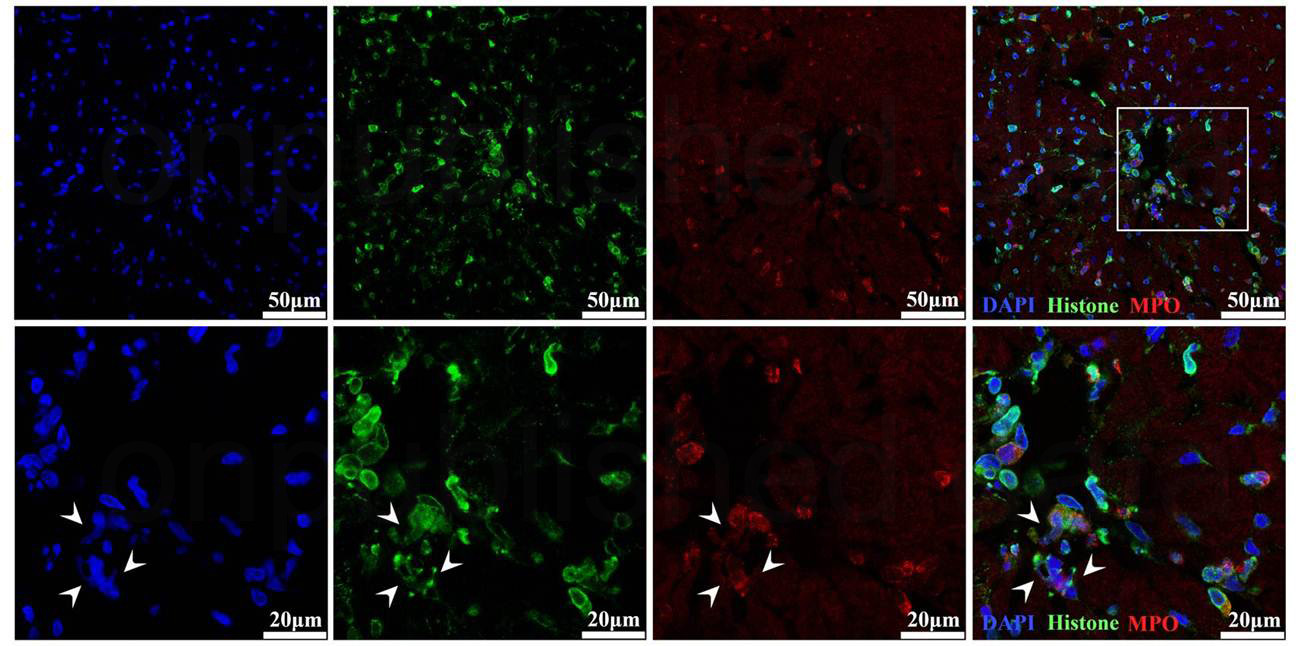
图2:共聚焦荧光显微镜检测缺血再灌注心肌内NETs。共聚焦荧光显微镜分析显示呈蓝色荧光的DNA,呈绿色荧光的组蛋白,呈红色荧光的MPO在缺血再灌注的心肌内共表达(白色箭头指示部位),提示NETs存在于缺血再灌注心肌。放大区域进一步显示再灌注心肌内NETs的形态。
作为改善微循环药物,曲美他嗪对局部缺血心肌具有保护作用。研究证实前壁心肌梗死病人应用曲美他嗪能降低梗死面积。然而曲美他嗪的分子作用机制目前还有待研究。有研究发现在体外实验,抗心绞痛药物曲美他嗪能抑制中性粒细胞活化,同时Williams等证实曲美他嗪能抑制兔子心肌缺血再灌注损伤中性粒细胞浸润从而保护心脏功能[18]。Isabella Tritto等证实在大鼠曲美他嗪能降低中性粒细胞介导的缺血再灌注损伤,但是具体机制还有待于进一步研究[19]。
基于上述证据,我们提出如下假设:曲美他嗪能减少缺血区域中性粒细胞胞外核酸网的产生从而改善心脏结构及功能。在本项目中,我们拟在动物和人群水平观察负荷量曲美他嗪对缺血再灌注损伤是否存在保护作用。长期应用曲美他嗪治疗,是否能降低NETs产生,改善缺血后心室重塑。急性心肌梗死患者给予负荷量曲美他嗪是否能减少NETs产生,长期服用曲美他嗪是否能降低NETs产生,改善心脏结构和功能。
通过国内外文献检索,曲美他嗪能否对NETs形成及NETs中介的血栓形成产生影响未见报道。通过研究,不仅为NETs形成提供新的干预机制,也为曲美他嗪新的临床适应症提供依据。
参考文献:
[1]Thygesen K, Alpert JS, Jaffe AS et al. Third universal definition of myocardial infarction[J]. Journal of the American College of Cardiology,2012,60(16):1581-1598.
[2]Widgerow AD. Ischemia-reperfusion injury: influencing the microcirculatory and cellular environment[J]. Annals of plastic surgery,2014,72(2):253-260.
[3]Yellon DM & Baxter GF. Protecting the ischaemic and reperfused myocardium in acute myocardial infarction: distant dream or near reality?[J]. Heart,2000,83(4):381-387.
[4]Savchenko AS, Borissoff JI, Martinod K et al. VWF-mediated leukocyte recruitment with chromatin decondensation by PAD4 increases myocardial ischemia/reperfusion injury in mice[J]. Blood,2014,123(1):141-148.
[5]Yellon DM & Hausenloy DJ. Myocardial reperfusion injury[J]. The New England journal of medicine,2007,357(11):1121-1135.
[6]Romson JL, Hook BG, Kunkel SL et al. Reduction of the extent of ischemic myocardial injury by neutrophil depletion in the dog[J]. Circulation,1983,67(5):1016-1023.
[7]Mullane KM, Read N, Salmon JA & Moncada S. Role of leukocytes in acute myocardial infarction in anesthetized dogs: relationship to myocardial salvage by anti-inflammatory drugs[J]. The Journal of pharmacology and experimental therapeutics,1984,228(2):510-522.
[8]Kitano K, Usui S, Ootsuji H et al. Rho-kinase activation in leukocytes plays a pivotal role in myocardial ischemia/reperfusion injury[J]. PloS one,2014,9(3):e92242.
[9]Remijsen Q, Kuijpers TW, Wirawan E et al. Dying for a cause: NETosis, mechanisms behind an antimicrobial cell death modality[J]. Cell death and differentiation,2011,18(4):581-588.
[10]Brinkmann V, Reichard U, Goosmann C et al. Neutrophil extracellular traps kill bacteria[J]. Science,2004,303(5663):1532-1535.
[11]Steinberg BE & Grinstein S. Unconventional roles of the NADPH oxidase: signaling, ion homeostasis, and cell death[J]. Science's STKE : signal transduction knowledge environment,2007,2007(379):pe11.
[12]Dwivedi N & Radic M. Citrullination of autoantigens implicates NETosis in the induction of autoimmunity[J]. Annals of the rheumatic diseases,2014,73(3):483-491.
[13]Papayannopoulos V & Zychlinsky A. NETs: a new strategy for using old weapons[J]. Trends in immunology,2009,30(11):513-521.
[14]Massberg S, Grahl L, von Bruehl ML et al. Reciprocal coupling of coagulation and innate immunity via neutrophil serine proteases[J]. Nature medicine,2010,16(8):887-896.
[15]Fuchs TA, Brill A, Duerschmied D et al. Extracellular DNA traps promote thrombosis[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(36):15880-15885.
[16]Karakurum M, Shreeniwas R, Chen J et al. Hypoxic induction of interleukin-8 gene expression in human endothelial cells[J]. The Journal of clinical investigation,1994,93(4):1564-1570.
[17]Fuchs TA, Abed U, Goosmann C et al. Novel cell death program leads to neutrophil extracellular traps[J]. The Journal of cell biology,2007,176(2):231-241.
[18]Williams FM, Tanda K, Kus M & Williams TJ. Trimetazidine inhibits neutrophil accumulation after myocardial ischaemia and reperfusion in rabbits[J]. Journal of cardiovascular pharmacology,1993,22(6):828-833.
[19Tritto I, Wang P, Kuppusamy P et al. The anti-anginal drug trimetazidine reduces neutrophil-mediated cardiac reperfusion injury[J]. Journal of cardiovascular pharmacology,2005,46(1):89-98.
研究内容及研究方案
研究目标:
(1)负荷量曲美他嗪对缺血再灌注损伤是否存在保护作用。
(2)长期应用曲美他嗪是否能通过减少缺血区域NETs的产生改善心脏结构和功能。
研究内容:
1动物实验
(1)Wistar大鼠心梗模型的建立:
① 腹腔注射0.4%戊巴比妥钠(40 mg/kg)麻醉大鼠。待大鼠腹面向上时将其固定于手术台上。颈部、胸部及下肢备皮。用电极针连接体表心电图设备。
② 颈部及胸部手术范围75%乙醇消毒。
③ 颈部正中纵向剪开颈部皮肤约1-2 cm,钝性分离肌肉,暴露气管约1 cm。
④ 左手持弯止血钳撑开鼠口,右手将由穿刺针引导的头皮针塑料管插入气管内,观察暴露的气管判断气管插管是否成功,成功后将穿刺针撤出,头皮针塑料管保留于气管内,用于术中连接呼吸机。
⑤ 连接并打开呼吸机。于胸骨左缘4-5肋间行1-1.5 cm横切口,以止血钳分离皮下组织,钝性分离胸大肌,暴露左侧肋骨。
⑥ 于左侧第四肋间,用剪刀头向上挑起并剪断肋骨,防止剪破心脏,用弯止血钳撑开4、5肋骨,左手轻压胸腔将心脏挤出,向左侧翻转暴露左心耳。
⑦ 于肺动脉圆锥和左心耳交界处,主动脉起始部下约2-3 mm处即左冠状动脉开口处附近,使用带有缝合线的缝合针自左心室侧穿入由肺动脉圆锥侧穿出,于结扎处放置1 cm长橡皮条,连同心肌和橡皮条一起结扎,结扎成功后可见心脏前壁运动幅度减弱,心电图示ST段进行性弓背向上抬高。
⑧ 迅速将心脏放回胸腔,减少心脏暴露胸腔外的时间,排出胸腔内气体,用直止血钳夹紧闭合胸腔。观察15 min,待大鼠呼吸和心率平稳后撤去呼吸机。
⑨ 结扎45 min后,再次连接呼吸机,打开胸腔,用止血钳撑开4、5肋骨,暴露心脏,剪断结扎线,取出胶条,使原结扎冠状动脉再通,闭合胸腔,呼吸平稳后撤去呼吸机。
(2)曲美他嗪给药途径、时间、剂量的确定:
大鼠曲美他嗪负荷量给药为静脉给药3.5mg/kg,长期给药方式为灌胃给药,剂量为30 mg/kg/d,给药时间窗为30天。
(3)短期实验评估心肌梗死面积和解剖无复流面积
① 心肌梗死面积的确定— Evans blue与TTC双染:为了确定心肌梗死区域,于再灌注3h后,大鼠心肌 Evans blue与TTC双染。TTC可以与存活心肌细胞线粒体内的琥珀酸脱氢酶反应,生成砖红色的甲月赞,而死亡的心肌细胞不能与TTC发生反应,呈苍白色。此时,经过Evans blue与TTC双染后的心肌,未被蓝色染料覆盖的部分为缺血心肌,其范围内的砖红色区域为缺血区域内因为再灌注而挽救的心肌,而白色区域为坏死心肌。
② 解剖无复流面积的确定— Evans blue与硫磺素S双染:为了确定无复流区域,于再灌注3h后,大鼠心肌Evans blue与硫磺素S双染。后荧光显微镜下观察。蓝黑色区域为血流灌注区域,未被蓝黑色染料浸润的区域为结扎所导致的缺血区域,荧光蓝色区域为硫磺素S与内皮细胞结合区域,此处为再灌注后血液复流的区域,黑色的区域为再灌注后血流未恢复的区域,即无复流区域。
(4)长期实验评估心脏结构和功能:
① 无创心脏二维超声检查:实验各组大鼠于手术后30天时采用心脏二维超声检查评估大鼠心脏结构及功能。测定左心室收缩期和舒张期左室内径(LV internal diameter at end-systole/LV internal diameter at end-diastole, LVIDs/LVIDd),收缩末期及舒张末期室间隔厚度(interventricular septal thickness at end-systole/ interventricular septal thickness at end-diastole, IVSs/IVSd),左室收缩末期和舒张末期容积(end-systolic volume/ end-diastolic volume, ESV/EDV)。应用Teichholtz公式计算出心脏射血分数(ejection fraction, EF)和短轴缩短率(fractional shortening, FS)。
② 有创血流动力学检测评估:长期实验各组大鼠于手术后30天时测量血流动力学。记录左心室舒张末压(left ventricular end diastolic pressure, LVEDP)、左心室收缩末压(left ventricular end systolic pressure, LVSP)、左心室压力最大上升速度(maximal slope of systolic pressure increment, +dP/dtmax)和左心室压力最大下降速度(maximal slope of diastolic pressure increment, -dP/dtmin)。
(6)病理学分析:
① Masson染色测量心脏扩张指数:将浸泡于10%中性甲醛溶液中的心肌组织用Masson染色,应用扫描仪对心肌进行扫描,应用Image Pro Plus 4.5图像分析软件分别测量左心室游离壁厚度(left ventricular free wall thickness, LVWT)、室间隔厚度(septum thickness, SPT)、左室壁横断面积(left ventricle area, LVA)、左室腔横断面积(left ventricle cavity area, LVCA)。计算左室膨展指数(index of expansion, IE)。公式为:IE= (LVCA / LVA) × (SPT / LVWT)。
② WGA染色观察心肌细胞横断面面积:WGA染色后,应用荧光显微镜于400倍视野下对室间隔心肌进行扫描,应用Image Pro Plus 4.5图像分析软件定标,选取细胞核居中且呈圆形的心肌细胞手动描记轮廓,测量其横断面面积(myocardial cross-sectional area, MCSA),每个样本至少选取40个心肌细胞。计算心肌细胞横断面面积平均值。
③ 免疫荧光染色:核染色质( DNA),组蛋白(Histone 2B),中性粒细胞(MPO)
共聚焦荧光显微镜分析显示DNA、组蛋白、MPO共表达的部位为NETs存在的区域。
2人群研究
(1)入选标准:急性心肌梗死需急诊行PCI病人。
(2)排除标准:PCI术未开通罪犯血管的患者。
(3)曲美他嗪给药时间、剂量的确定:负荷量60mg于PCI术前给药。后30mg bid维持1年。
(4)PCI术中测校正冠脉TIMI血流帧数。
(5)PicoGreen检测血浆中NETs:
血浆准备:
① 无菌、无热源采血针取血,EDTA抗凝负压采血管收集约2ml;
② 尽快处理血样(不应超过1小时),1500转离心10分钟;
③ 留取上清,-20℃保存。
PicoGreen检测(设复孔):
① 按1:200稀释PicoGreen;
② 建立标准曲线:分别建立浓度梯度为1000、500、250、100、0的标准曲线,4μl+196μlTE工作液混匀;95μl上步的混合液+95μlTE工作液混匀;80μl上步的混合液+80μlTE工作液混匀;50μl上步的混合液+75μlTE工作液混匀;100μlTE工作液;分别取100μl加入孔中,再加入100μl稀释好的PicoGreen,从而建立标准曲线(为通过坐标原点的直线)。
③ 酶标板中先加入100μl血浆,再加入100μl稀释好的PicoGreen;
④ 避光5分钟后,荧光酶标仪读数分析NETs水平。
拟解决的关键问题:
再灌注治疗能够挽救急性心肌梗死的缺血心肌,然而缺血再灌注损伤诱导的心肌顿抑、再灌注心律失常、微血管功能失调以及无复流现象的出现明显削弱了心肌获益。新近研究显示中性粒细胞胞外核酸网(neutrophil extracellular traps, NETs)的产生与血栓形成密切相关。本课题组前期工作发现大鼠I/R心肌内存在NETs,干预NETs的产生可降低I/R后心肌梗死面积,提高心肌灌注水平,改善缺血后心室重塑。作为心血管治疗用药,曲美他嗪对缺血心肌具有保护作用。然而其具体分子机制还有待进一步研究。有体外研究证明曲美他嗪能够抑制中性粒细胞活化。因此在本项目中我们拟解决如下关键问题:
(1)曲美他嗪是否能通过减少缺血区域NETs的产生改善心脏结构和功能。
(2)大鼠I/R模型建立前应用负荷量曲美他嗪是否能减少I/R后心肌梗死面积,提高心肌灌注水平,长期应用曲美他嗪治疗,是否能降低NETs产生,改善缺血后心室重塑。
(3)急性心肌梗死患者给予负荷量曲美他嗪是否能减少NETs产生,长期服用曲美他嗪是否能降低NETs产生,改善心脏结构和功能。
研究方法:
(1)无创心脏二维超声检查和有创血流动力学检测评估大鼠心脏功能及血流动力学改变情况。
(2)Evans blue与TTC双染确定大鼠心肌梗死面积,Evans blue与硫磺素S双染确定解剖无复流面积。
(3)Masson染色测量心脏扩张指数,WGA染色观察心肌细胞横断面面积。
(4)大鼠心肌组织DNA、组蛋白、MPO免疫荧光染色确定NETs。
(5)PicoGreen检测患者血浆NETs水平。
(6)心脏彩超检测患者心脏结构及功能变化。
技术路线:
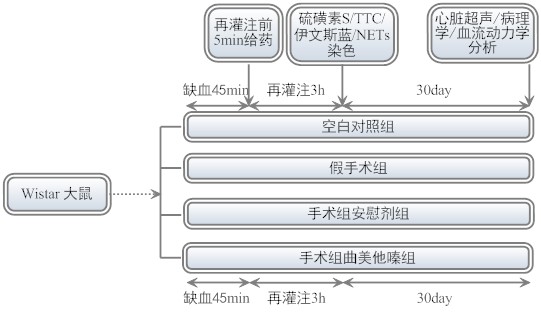
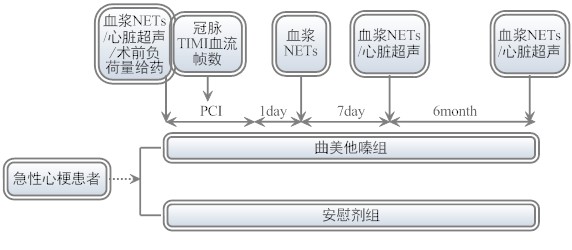
实验方案:
动物实验:6周龄雄性Wistar大鼠适应性喂养 1周后,随机分组。初步分为空白对照组、假手术组和手术组。假手术组只穿线不结扎血管。手术组大鼠开胸结扎冠状动脉左前降支45min后再灌注 3 h。手术组大鼠分为安慰剂组和曲美他嗪组。曲美他嗪组于再灌注开始前5 min静脉注射3.5mg/kg曲美他嗪。通过氯化三苯基四氮唑(triphenyltetrazolium chloride, TTC)和伊文斯蓝(Evans blue)双重染色评估干预药物对于大鼠心肌梗死面积的影响。通过硫磺素S和伊文斯蓝双重染色评估干预药物对于大鼠心肌无复流面积的影响。通过组蛋白2B(histone 2B, H2B)、髓过氧化物酶(myeloperoxidase, MPO)以及脱氧核糖核酸(deoxyribonucleic acid, DNA)的三色免疫荧光激光共聚焦显微成像检测心肌组织是否存在NETs。长期实验在保留短期实验手术组的基础上,分别给予普通饮食,和添加曲美他嗪药物的饮食,喂养30天。应用无创心脏二维超声检查和有创血流动力学检测评估大鼠心脏功能及血流动力学改变情况。心脏取材后利用马松三色染色(Masson trichrome staining)分析左室梗死区游离壁厚度(left ventricular free wall thickness, LVWT)、室间隔厚度(septum thickness, SPT),并计算心脏膨展指数(index of expansion, IE)。应用麦胚凝集素(wheat germ agglutinin, WGA)染色分析心肌细胞横断面积(myocardial cross-sectional area, MCSA)。三色免疫荧光染色检测心肌组织NETs水平。
人群研究:急性心肌梗死需急诊行PCI病人入院后取血用PicoGreen检测法测定基线NETs水平,并行心脏超声检查。随机分为曲美他嗪组和安慰剂对照组,曲美他嗪组急诊PCI术前给予负荷量曲美他嗪60mg,后每日30mg bid给药长期维持。PCI术中记录校正冠脉TIMI血流帧数。术后各亚组患者第1天、第7天取血测定NETs水平,复查心脏超声,PCI术后6个月复查心脏超声及血浆NETs水平。
可行性分析:
(1)项目申请人从事冠心病基础和临床研究多年,充分掌握国内外研究现状。
(2)研究人员熟练掌握了完成实验所需的基本实验技术。
(3)中国人民武装警察部队后勤学院附属医院心脏中心具备完成本研究的实验设备,能够保证项目的顺利实施。研究所需实验试剂与耗材均可在国内外订购。
统计学方法:
两组间数据比较采用t检验。多组数据的比较采用单因素方差分析(One way ANOVA),组内两两比较使用Newman-Keuls检验。统计学处理由GraphPad Prism 5.0统计软件完成,以P<0.05作为具有统计学意义的标准。所有数据以均值±标准误( ±SEM)表示。
研究计划:
2015.02-2015.08 Wistar大鼠I/R模型建立,评估负荷量曲美他嗪干预后心肌梗死面积和解剖无复流面积,大鼠曲美他嗪长期药物干预;人群病例的收集。
2015.09-2016.02 曲美他嗪长期药物干预后大鼠心脏功能及血流动力学情况检测,病理学染色;人群病例的收集、整理、分析。
2016.03-2016.09 补充有关实验;论文撰写、结题报告整理、学术交流。
预期研究成果:
(1)应用负荷量曲美他嗪能减少I/R后心肌梗死面积,提高心肌灌注水平,长期应用曲美他嗪治疗,能降低NETs产生,改善缺血后心室重塑。
(2)急性心肌梗死患者给予负荷量曲美他嗪和长期服用曲美他嗪能降低NETs产生,改善心脏结构和功能。
(3)研究成果以论文形式公开发表。
研究基础
(1)在前期工作中我们发现在发生缺血再灌注的心肌微循环内有NETs的产生,联合使用DNase和rt-PA减少NETs产生能够减低心肌梗死的面积,提高心肌复流比例,进而改善远期心脏功能(此篇文章正在Am J Physiol Heart Physiol (影响因子4.012)修稿中)(修稿信息见图3),申请人为通讯作者。而且有研究证实,曲美他嗪能减少中性粒细胞介导的缺血再灌注损伤,但具体机制尚不清楚。这也为进一步研究曲美他嗪能否影响心肌缺血再灌注损伤诱导的NETs的产生奠定了理论基础和实验基础。
(2)大鼠心梗模型的建立技术成熟。实验人员熟练掌握了完成实验所需的基本实验技术。
(3)实验室拥有完成大鼠心功能检测的实验仪器和设备。
(4)导管室有先进的介入设备,术者有丰富的临床介入治疗的经验。
2、工作条件
本课题的主要工作将在武警部队心血管病研究所完成,已经具备完成动物实验造模、血流动力学检测、心功能检测、分子生物学、病理学检测的实验设备:Biopac MP150 16导生理记录仪、Millar Mikro-Tip 2F SPR-320大鼠压力导管、Inspira呼吸机、ABI 7300 Real-time PCR仪、E600POL偏振光显微镜、RM2016型石蜡切片机、ULTRACUT-R超薄切片机、NANO DROP 2000c紫外可见分光光度计、MDF-382E超低温冰箱、FA 1104电子天平、5804R低温高速离心机、KQ-250DE型数控超声波清洗器、恒温水浴锅、Milli-Q 超纯水、去离子水系统、MH-2800D多功能加热系统、GL-3250A磁力加热搅拌器、ECLIPSE 80i荧光显微镜、HITACHI-7500透射电子显微镜、Bio-RAD Model680酶标仪、HG2001迷你离心机、Bio-RAD电泳仪、Bio-RAD转膜仪、Thermo台式恒温振荡器、Bio-RAD Gel Doc2000凝胶成像系统、可调节的移液器及相应加样枪头。
中国人民武装警察部队后勤学院附属医院赵季红