消化在线: 曲美他嗪对心肌梗死后心衰大鼠治疗作用
来源:
曲美他嗪对心肌梗死后心衰大鼠治疗作用研究
立论依据
随着现代社会人口老龄化和人们生活方式中冠心病相关危险因素增加,近年来心肌梗死发病率呈逐年上升趋势,随着急性心肌梗死治疗手段的进步,尤其是再灌注治疗方法的应用使其早期死亡率不断降低,但转而变成了越来越多急性心肌梗死患者发展为不同程度旳心力衰竭,心衰的治疗策略虽然在近十余年里发生了根本性变化,从关注短期血流动力学改善转而针对心肌重构机制,防止和延缓重构的发展,取得了明显的成效,然而通过积极传统的抗心衰药物治疗后仍然存在相当一部分患者运动耐量下降,严重影响患者生活质量。从而探寻新的治疗靶点,进一步改善心梗后心衰患者生活质量成为心衰治疗主要研究方向。本研究通过建立心肌梗死大鼠模型,以曲美他嗪进行药物干预,探讨曲美他嗪通过改善心肌代谢方面对于心肌梗死后心衰大鼠治疗作用。
正常心肌能量主要来源于脂肪酸氧化和葡萄糖代谢,脂肪酸氧化为心脏提供约60%-70%能量,其余来自于葡萄糖氧化途径。葡萄糖代谢分为有氧氧化和无氧酵解,有氧氧化产生大部分能量。正常情况下脂肪酸氧化和葡萄糖代谢两条途径同时进行并相互影响,葡萄糖代谢过程受脂肪酸氧化速率的调节,但脂肪酸氧化比葡萄糖氧化耗氧多,而且脂肪酸代谢增强时还会使糖酵解的产物如乳酸等堆积,导致细胞内酸化加重。
当冠心病时心肌缺血缺氧,心肌葡萄糖的摄取增强。当出现重度缺血缺氧时氧供需失衡,葡萄糖摄取减少,有氧氧化减少,无氧酵解增加,脂肪酸氧化减少致ATP生成减少。同时,ATP酶的活性降低导致能量利用发生障碍。这些代谢紊乱导致细胞损害甚至死亡,产生功能、代谢和形态学改变以及电生理异常。
心脏能量代谢重构的概念是 2004 年由 Bilsen 等针对心力衰竭或心脏肥厚时能量变化提出的[1] 是指心脏疾病发生时,心肌能量以及能量底物代谢改变,这些变化包括线粒体功能受损、高能磷酸化合物的变化,及心肌产能途径转变等。
曲美他嗪(Trimetazidine,TMZ))为哌嗪类衍生物,其可通过抑制线粒体内长链 3-酮脂酰辅酶 A 硫解酶抑制脂肪酸β-氧化供能途径,使心肌能量代谢从脂肪酸β-氧化向葡萄糖氧化转变,实现在不改变血流动力学的情况下改善心肌的能量代谢。在正常情况下,95%的 ATP来自线粒体氧化磷酸化合成,5%来自糖酵解[2]。健康成年人心脏所需 50%—70%的 ATP 从脂肪酸氧化中获得,其他则大部分来自葡萄糖和乳酸等碳水化合物的氧化[3] 。游离脂肪酸氧化产生等量 ATP 的耗氧量比葡萄糖氧化的耗氧量高,而且高水平游离脂肪酸氧化可明显抑制葡萄糖氧化的速率。Ihsan等人的研究[4]证明曲美他嗪具有减轻氧化应激的作用,通过增加内源性抗氧化剂如过氧化物歧化酶(SOD)、谷腕甘肽过氧化物酶(GPx),减少氧自由基,减轻缺血一再灌注损伤的氧化应激反应。另有动物实验表明曲美他嗉还具有降低炎症介质IL-6的水平发挥抗炎作用保持心肌细胞电活动的稳定性。曲美他嗪心脏保护效应表现在通过改善能量代谢,从而改善内皮功能、抑制细胞凋亡、抑制炎症反应,减少氧化应激损伤,并能够使心肌细胞内钙离子通透性增高[5]。
腺苷酸活化蛋白激酶(AMPK)是重要的细胞能量感受器。AMPK是一个异源三聚体蛋白,包括一个催化亚基(α-亚基))和两个调节亚基(β-亚基和γ-亚基)。AMPK是一种在真核细胞生物中广泛存在的丝氨酸/苏氨酸蛋白激酶,主要协调代谢和能量的需要[6,7],能通过多种途径激活,尤其当细胞内发生能量信号变化时[8]。AMPK激活后,可以加速分解代谢途径(脂肪酸氧化、葡萄糖转运和糖酵解),抑制合成途径(糖异生、蛋白质合成、脂肪酸和胆固醇的合成),以降低能量消耗,维持能量的储存。AMPK通过影响线粒体生成、蛋白质合成及分解在细胞的生长和分化过程中发挥重要作用[9]。另有大量研究证实,在肿瘤组织中,AMPK激活后能抑制细胞内蛋白质、脂肪酸、多糖的合成[10-12]。其活性调节机制:(1)AMP/ATP调节途径: AMP/ATP比率增高时活性增强,一方面关闭消耗ATP的合成代谢途径,另一方面启动产生ATP的分解代谢途径[13-15]。(2)非AMP依赖的调节通路:包括类似AMP作用的调节通路和AMPKK调节通路。研究表明,体外纯化的重组LKB1复合体能够直接磷酸化AMPK,在能量不足的应激状态下,LKB1/AMPK信号途径的激活促使细胞关闭耗能的生物反应,减ATP的消耗从而逆转AMP/ATP的高比值,而在LKB1 / AMPK通路失活的情况下,如果AMP / ATP高比值状态不能逆转,细胞将最终因能量耗竭而死亡。这些反映了 LKB1能够协同AMPK,维持细胞能量平衡的作用[16]。许多生理和病理环境,如缺氧和生理运动也与AMPK活性相关。研究表明AMPK可通过磷酸化6-磷酸果糖激酶-2(PFK2)合成2,6-双磷酸果糖,促进糖酵解过程。
过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1)是一种转录辅激活因子,通过与转录因子结合,参与靶基因的转录调控。PGC-1能提高与线粒体生物合成和功能相关的基因:线粒体转录激活因子,Tim22,异柠檬酸氢化酶,肉碱脂酰转移酶,细胞色素C和ATP合成酶β,以往大量研究多集中在运动可提高骨骼肌PGC-1表达[17],然而Smita等发现心脏衰竭可能是由于ERRα和PGC-1表达降低,引起线粒体功能紊乱,导致心肌细胞能量供应不足引起的[18]. AMPK是PGC-1的上游调节蛋白之一。 Leick L 等[19]比较了皮下注射AICAR和生理盐水(安慰剂)对PGC-1全身敲除小鼠和同窝野生型小鼠GLUT4和线粒体蛋白的影响,发现PGC-1是AICAR处理引起的小鼠骨豁肌中GLUT4、cyt C和COX-I蛋白表达增加所必需的,提示AMPK通过PGC-1调节线粒体蛋白和GLUT4。
本研究通过建立心肌梗死后心衰大鼠模型并应用曲美他嗪进行干预,采用分子生物学研究方法分析心肌梗死后心衰大鼠心肌能量代谢变化,探究AMPK信号通路在心肌梗死后心衰大鼠心肌表达及曲美他嗪干预作用。为临床心梗后心衰治疗提供一种新的方法和途径。
参考文献:
1. Bilsen M, Smeets P, Gilde A, et al. Metabolic remodeling of the failing heart: the cardiac burn-out syndrome?. Cardiovasc Res, 2004, 61(2):218-226.
2. Lopaschuk GD et al Myocardial fatty acid metabolism in health and disease. Physiol Rev. 2010;90:207-258.
3. Lopaschuk GD, Belke DD, Gamble J, et al: Regulation of fatty acid oxidation in the mammalian heart in health and disease. Biochem Byophys Acta 1994; 1213: 263-276.
4. Ihsan Iskesen, Osman Saribulvul, et al. Trimetazidine Reduces Oxidative Stress in Cardiac Surgery. Circ J 2006;70:1169-73.
5.Ferrari R.The role of mitochondria in ischemic heart disease.J Cardiovasc Pharmacol,1996,28(suppl 1):S1-5.
6.Shi J,Wang Y, Luo G. Ligustrazine phosphate ethosomes for treatment of Alzheimer's disease, in vitro and in animal model studies. AAPS Pharm Sci Tech.2012; 13(2):485-92.
7.Alters Mansuy-Aubert V,Zhou QL,Xie X, Gong Z,Huang JY, et al.Imbalance between Neutrophil Elastase and its Inhibitor a 1-Antitrypsin in Obesity Insulin Sensitivity, Inflammation,and Energy Expenditure. Cell Metab. 2013; 17(4): 534-48.
8.Kim M, Tian R. Targeting AMPK for cardiac protection:opportunities and challenges.J Mol Cell Cardiol,2011,51(4):548-553.
9.Lou Z, Zang M, Guo W,AMPK as a metabolic tumor suppressor: control of metabolism and cell growth. Future Oncol,2010,6(3):457-470.
10.Dupont J,Reverchon M, Cloix L,Froment P, Rame C. Involvement of adipokines, AMPK, PI3K and the PPAR signaling pathways in ovarian follicle development and cancer. Int J Dev Biol. 2012; 56(10-12): 959-67.
11.Hardie DG. The LKBl-AMPK pathway-friend or foe in cancer? Cancer Cell.2013; 23(2): 131-2.
12.Rios M, Foretz M,Viollet B,Prieto A, Fraga M, Costoya J A, Senaris R. AMPK Activation by Oncogenesis Is Required to Maintain Cancer Cell Proliferation in Astrocytic Tumors. Cancer Res. 2013. Epub ahead of print.
13.Shintani Y,Kapoor A,Kaneko M,et al.TLR9 mediates cellular protection by modulating energy metabolism in cardiomyocytes and neurons. Proc Natl Acad Sci USA. 2013; 110(13): 5109-14.
14.OTSFeill HM. AMPK and Exercise: Glucose Uptake and Insulin Sensitivity.Diabetes Metab J. 2013; 37(1): 1-21.
15.Yuan HX, Xiong Y, Guan KL. Nutrient sensing, metabolism, and cell growth control. Mol Cell. 2013; 49(3): 379-87.
16. Shaw RJ, Kosmatka M,Bardeesy N,Hurley RL, Witters LA, DePinho RA, Cantley LC: The tumor suppressor LKBl kinase directly activates AMP-activated kinase and regulates apoptosis in response to energy stress. Proc Natl Acad Sci USA 101:3329-3335, 2004.
17.Oliveira NR, Marques SO, Luciano TF,et al. Treadmill training increases SIRT-1 and PGC-1 α protein levels and AMPK phosphorylation in quadriceps of middle-aged rats in an intensity-dependent manner.Mediators Inflamm.2014;2014:987017.
18. Sihag S.,Cresci S.,Li A.Y., et ah PGC-1α and ERRα target gene downregulation is a signature of the failing human heart. J Mol Cell Cardiol, 2009,46(2): 201-212.
19. Leick L.,Fentz J., Bienso R.S., et al. PGC-1 αis required for AICAR-induced expression of GLUT4 and mitochondrial proteins in mouse skeletal muscle. Am J Physiol Endocrinol Metab,2010,299(3): E456-465.
研究内容及研究方案
1、研究目标:
本研究通过建立心肌梗死后心衰大鼠模型并应用曲美他嗪进行干预,阐明曲美他嗪对心肌梗死后心衰治疗作用及机制。
2、研究内容:
建立心肌梗死后心衰大鼠模型,分析心肌梗死后心衰大鼠中心肌代谢及心肌细胞凋亡指标变化,并以曲美他嗪进行干预,观察曲美他嗪对心肌梗死后心衰大鼠治疗效果。
3、拟解决的关键问题:
(1)心肌梗死后心衰大鼠模型制备。
(2)心肌梗死后心衰大鼠心肌代谢指标变化。
(3)曲美他嗪对心肌梗死后心衰保护机制。
二、拟采取的研究方法、技术路线、实验方案及可行性分析、统计学方法:
1、拟采取的研究方法:
(1)大鼠心肌梗死模型建立:
选用清洁级雄性Wistar大鼠,体重(300±50)g,3%戊巴比妥钠注射液1.5mg/Kg腹腔注射麻醉大鼠,固定大鼠四肢及头部,连接心电图,经口进行气管插管,接小动物呼吸机,设潮气量20-30ml/Kg。开胸结扎冠脉:剪去胸毛,碘伏消毒,铺巾,经胸4-5肋间做斜行切口,暴露心脏,剥脱心包,暴露左心耳与肺动脉圆锥间静脉(冠脉主干在此与静脉伴行),以此静脉为标记进行结扎,用5/0带线缝合针在左心耳下3-5mm、静脉周围1.5-2厘米左冠状动脉处缝1针,进行结扎,(假手术组只穿线不结扎),关胸,抽出腔内气体保持负压,逐层缝合。冠脉结扎成功标志:左心室前壁及心尖周围组织颜色变暗或青紫或运动减弱,心电图ST段弓背向上抬高或病理性Q波形成,R波振幅减低。
(2)实验动物分组:
A组:心肌梗死模型组;B组:心肌梗死模型+曲美他嗪组:心肌梗死模型制备后以3mg/kg曲美他嗪进行每日两次灌胃;C组:假手术组:手术过程中只进行缝针不进行结扎冠状动脉。D组:假手术+曲美他嗪组。
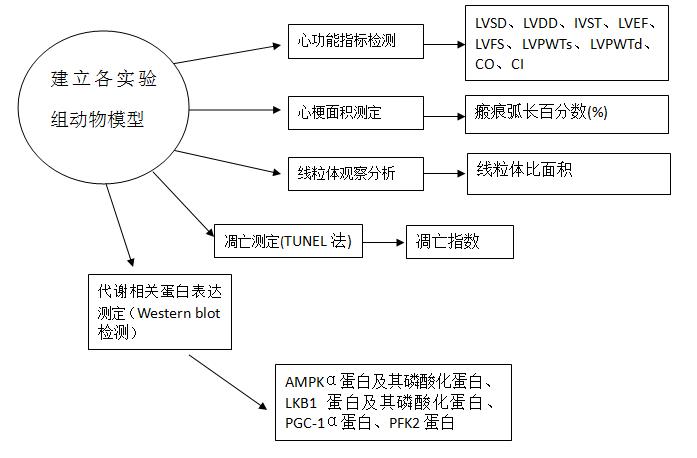
(3)心功能参数检测:
由专业超声医师检查各组大鼠心室结构及心功能,计量资料连续测量3个心动周期取平均值。利用HP500型彩色多普勒(M型)超声心动图仪分别于心梗术前、心梗后一周、两周、四周检测心功能参数,包括左心室收缩末期内径(LVSD)、左心室舒张末期内径(LVDD)、室间隔厚度(IVST)、左心室射血分数(LVEF)、左心室短轴缩短率(LVFS)、左心室后壁收缩期厚度(LVPWTs)及左心室后壁舒张期厚度(LVPWTd)、心输出量(CO)和心脏指数(CI)。
(4)心肌梗死面积测定:
造模4周后处死大鼠,取出心脏,取结扎部位以下 5-6mm心肌组织常规石蜡包埋切片,HE染色。数码相机拍摄左心室横截面切片,使用 Image Pro-Plus 6.0 图像分析系统测量各弧长、周长、面积厚度,以瘢痕弧长百分数计算心肌梗死面积,瘢痕弧长百分数(%)=瘢痕弧长/[( 外周长+内周长) /2×100% 。
(5)线粒体观察分析:
透射电镜( JEM -1230) 观察各组心肌样本线粒体并拍照。每份心肌样本分别以 10 000 倍和 200 000 倍放大比例随机选取不同部位拍摄心肌和线粒体各 4 张图像。图像分析系统测量分析线粒体比面积( = 每张照片线粒体总面积/视野总面积) 和每张线粒体照片中至少30个点的嵴间距,并计算变化率( % ) 。
(6) 应用TUNEL法原位检测心肌细胞凋亡情况
将大鼠组织进行石蜡切片并经二甲苯脱蜡,梯度乙醇水合,0.1mol/L PBS(pH7.4)浸浴15min×2次;封闭液室温固定30min后PBS浸浴15min×2次;透膜液室温浸浴3~5min;玻片在PBS浸浴5min×2次;加入TUNEL标记反应混合物20~25μl,湿盒内37℃孵育1h,轻轻摇洗5min×3次;弃去PBS,每张盖玻片加1:1000的HOCHEST染核,暗室内室温孵育10min;再经PBS摇洗5min×3次,弃去PBS,经过荧光显微镜观察,激发波长为450~500nm,发射波长515~565nm,TUNEL混合液中不加TdT的切片作阴性对照,阳性的凋亡细胞核呈绿色,阴性细胞呈蓝色。每个切片随机选择10个视野,高倍镜下计数500~1000个细胞中的阳性细胞数,其阳性细胞百分率即为凋亡指数(Apoptosis index,AI)。
(7) Western blot检测相关蛋白表达
配置细胞裂解液,以每1g心肌组织加3ml裂解液的比例制成组织匀浆,冰浴1h后4℃离心10min,取上清液。按照BCA试剂盒说明书配置BCA蛋白测定标准液,应用酶标仪测出样品的吸光度并计算组织上清液中的蛋白含量。蛋白质样品沸水加热10min后置于冰水中冷却,然后进行10%的SDS-PAGE。再将蛋白质从凝胶上转移到PVDF膜上,4℃封闭过夜。加入兔抗大鼠一抗,37℃孵育2h,洗膜后再加入辣根酶标记羊抗鼠IgG,37℃孵育1h,加入ECL发光底物用Bio-Rad凝胶成像系统的曝光。应用Gel Pro 4. 0软件对所得蛋白条带进行分析。依次测定相关蛋白AMPKα蛋白及其磷酸化蛋白、LKB1蛋白及其磷酸化蛋白、PGC-1α蛋白、PFK2蛋白表达情况。
2、技术路线
3、可行性分析:
(1)我校拥有中心实验室,卫生部细胞移植重点实验室等一批能够承担重点课题的实验室。心血管实验室拥有完成实验内容所需全部仪器、设备,拥有梯度PCR仪,超速离心机,高速冷冻离心机,超净培养系统,激光共聚焦显微镜,细胞培养间,速率降温仪,凝胶成像系统,超低温冰箱,核酸蛋白定量仪,超纯水系统等一系列国内外大中型设备,能够进行本研究所涉及的免疫学、分子生物学、细胞生物学的全部研究。
(2)本研究采用的技术是国内外成熟的技术,且大多数关键技术本实验已经应用和建立(如心肌梗死后心衰动物模型的构建、蛋白表达检测等),实验中所涉及材料和试剂均为试剂盒,操作方便。因此,研究方案从理论到实践都是可行的,可以完成任务目标。
4、统计学方法:
应用SPSS 17.0统计软件包,计量资料以均数±标准差表示。对主要统计指标均进行正态性及方差齐性检验,组内、组间数据比较采用单因素方差分析或t检验。以P<0.05为差异有统计学意义。
三、研究计划及预期研究成果:
1.研究计划
2015年1月-2015年6月 人员安排,购置各种试剂、耗材。相关文献的查阅。
2015年7月-2015年12月 饲养Wistar大鼠,构建心肌梗死后心衰大鼠模型。
2016年1月-2016年6月 超声等检测各组实验动物心脏结构和功能,检测心梗面积、线粒体比面积及凋亡指数,依次测定相关蛋白AMPKα蛋白及其磷酸化蛋白、LKB1蛋白及其磷酸化蛋白、PGC-1α蛋白、PFK2蛋白表达情况。
2016年7月-2016年12月 实验成果全面总结,文章撰写,成果鉴定上报。
2.预期研究成果
(1)成功构建心肌梗死后心衰大鼠模型,明确AMPK信号通路在心肌梗死后心衰大鼠心肌表达及曲美他嗪干预作用。
(2)明确曲美他嗪对心肌梗死后心衰大鼠心肌细胞凋亡影响。
(3)发表SCI或核心期刊文章1-2篇。
(4)培养硕士研究生1-2名。
研究基础
井玲教授一直从事心血管疾病研究工作,近年来在冠心病、心肌代谢、酒精性心肌病等研究领域积累了丰富的经验,已经发表SCI收录文章5篇,累计影响因子10.275,总他引16次;发表中华级国家核心期刊文章10余篇。获省高校科学技术一等奖、黑龙江省医药卫生科技进步奖一等奖、黑龙江省政府科技进步奖三等奖等。
哈尔滨医科大学和我院拥有中心实验室,卫生部细胞移植重点实验室等一批能够承担重点课题的实验室。拥有完成实验内容所需全部仪器、设备,拥有梯度PCR仪,超速离心机,高速冷冻离心机,超净培养系统,激光共聚焦显微镜,百级细胞培养间,速率降温仪,凝胶成像系统,超低温冰箱,核酸蛋白定量仪,超纯水系统等一系列国内外大中型设备,能够进行本研究所涉及的免疫学、分子生物学、细胞生物学的全部研究。
课题组成员能够熟练进行各种技术操作。相信在原有工作基础上,在课题组全体成员的共同努力下,该课题一定能够顺利实施并完成。
哈尔滨医科大学附属第一医院井玲