消化在线: 心力衰竭氧化应激机制曲美他嗪干预实验
来源:
一、立论依据
心力衰竭(HF)是冠心病、高血压、瓣膜病以及心肌病等多种心血管疾病的最终转归。目前,根据美国卫生研究所的流行病学报告,现时美国有5百多万HF患者,每年治疗心衰共耗费350亿美元[1]。根据 Framingham的研究表明,即使近年,随着ACEI/ARB、β受体阻滞剂以及醛固酮受体拮抗剂的使用的普及,HF的治疗方面有很大的进步,但HF患者的长期预后并不乐观[2],5年生存率与肺部肿瘤相当。在我国,心衰的发病率为1.1%[3],并且有继续上升到趋势。
一、心衰的机制
HF是因各种原因所致心做功能力下降,排量减少不能以致满足机体需要的一种病理状态。目前,对HF的机制的研究,主要集中在肾素-血管紧张素-醛固酮系统(RAAS)以及神经体液方面。
由于HF发生时流经球旁复合体的血流流量降低,激活RAAS,通过血管紧张素的释放,收缩血管床,维持外周血压。同时,血管紧张素的释放,刺激肾上腺皮质释放醛固酮,促进水钠重新吸收,维持有效血容量,提升血压。同时,由于肾上腺皮质释放。血管紧张素通过与AT1受体,醛固酮与盐皮质激素受体(MR)结合后,通过G蛋白经磷脂酶C(PLC)一步激活蛋白激酶C(PKC),PKC已经被证实能够通过β1-整合素[4],以及MAPKs途径[5],导致心肌细胞的重构[5]。在分子水平上,丝裂原活化蛋白激酶(MARKs)、以及钙离子超载被认为导致心肌重构,导致HF发生的原因。MAPKs是一类调节生长、分化、凋亡的细胞因子的总称[6]。在心肌缺氧等应激条件之下,MAPKs被激活,介导心肌凋亡因子的启动,使得心肌细胞重构的发生[7]。整合素是一种跨膜糖蛋白,连接着细胞内收缩性骨架蛋白和细胞外基质。整合素凭借自身链接细胞内外的特性,使细胞质区域的信号分子及细胞骨架蛋白互相作用对细胞骨架的构建,细胞凋亡细胞时间进行调控等。同时,整合素与MARKs有一定的重合、对通过ERK1/2、JNK和p38的激活,导致心肌肥厚以及心力衰竭的发生[8]。
在神经内分泌方面,由于心排量不足,导致心腔压力升高,启动神经体液机制进行补偿,大量分泌去甲肾上腺素(NE),兴奋心肌,增加心排量,同时收缩血管,维持血压。交感神经系统的激活被认为是心衰过程中重要的病理生理因素。心脏β肾上腺素能受体主要是β受体耦联于异源三聚体的G蛋白。G蛋白激活后,通过cAMP途径,激活PKAPKA可以磷酸化多种与心肌功能有关的蛋白质,如L型钙离子通道、受磷蛋白(PLN)、肌钙蛋白I(TnI)、RyRs、心脏型肌球蛋白结合蛋白(MyBP2C)等,通过增加钙离子内流,调整肌原纤维对Ca2+的敏感性而影响心肌细胞的收缩功能,并诱导心肌纤维化和细胞凋亡而导致心功能失调[9]。
二、氧化应激机制
氧化应激是指细胞中促氧化与抗氧化体系之间的平衡失调而倾向于前者,导致细胞内稳态紊乱。促氧化主要由活性氧(oxygen species,ROS)来完成。ROS是具有一个不配对电子的原子或原子团,主要包括氧自由基和非自由基的含氧产物,如超氧阴离子、羟自由基和过氧化氢等,其中由氧激发的称为氧自由基或活性氧。
生理情况下,机体氧自由基产生与细胞内抗氧化防御系统能维持一个动态平衡。适量的ROS可以杀灭细菌及清除白细胞,在宿主的主动防御中起到了积极的作用。在病理条件下,如缺血、炎症等情况下,由于心肌缺血缺氧及重要靶组织
尤其是能量代谢紊乱,细胞内钙离子超载,各种酶活力改变,机体通过黄嘌呤氧化酶,中性粒细胞的呼吸爆发及神经内分泌激活等途径代谢产生大量ROS,超过抗氧化机制的代偿能力,使得心肌细胞处于氧化应激状态[10]。
尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphateoxidase,NADPH oxidase,NOX)是人类发现的第一个主要产生ROS的酶,也被称为ROS产生的“心脏”。NOX是细胞内一组用于产生ROS的具有氧化活性的蛋白。研究[11]发现NOX又细胞膜上的p22phox,gp91phox两个亚基以及存在于胞浆中的4个亚基p47phox、p67phox、p40phox和小GTPase(Rac1、Rac2)所构成。当细胞受到外来刺激时,细胞浆中的p47phox、p67phox、p40phox以及Rac1亚基就会向细胞膜转位,与p22phox和gp91phox结合从而导致了ROS的产生。
三、氧化应激与心衰
临床研究表明[12],在HF的患者中,NOX的表达较正常健康对照组升高。HF患者中心肌和血管的黄嘌呤氧化酶的表达和活性增加,由于长期的压力负荷及容量负荷过重,使心肌张力升高,心肌肥厚,加重心肌缺血低氧,致使Ca2+进入心肌细胞内激活钙依赖性蛋白水解酶,造成黄嘌呤次黄嘌呤增多而产生ROS。而进一步的研究表明,RAAS、血管容量以及炎症反应都可以导致NOX的表达上升[13, 14]。ROS直接对心肌细胞的细胞内脂类、蛋白质和DNA发生反应,导致细胞损伤和死亡,进一步激活脂类释放炎症因子以及攻击使维持心肌细胞正常代谢的蛋白质以及DNA变性, 进一步加重氧化应激,造成心肌细胞的结构破坏和功能障碍。有
除了直接效应,ROS还可以激活MAPKs以及Capcase通路,启动心肌细胞凋亡信号转导的通路[15]。同时,ROS可以刺激成纤维母细胞的增值,激活活基质金属蛋白酶(MMPs)[16],破坏了正常的细胞外环境,导致NF-κB等各种生长因子的表达,引起心肌胶原重建,造成心肌重塑。
四、曲美他嗪治疗心衰
曲美他嗪是线粒体长链3一酮酰基辅酶A硫解酶( 3-KAT)抑制剂。其通过抑制3-KAT,减少抑制长链脂肪酸的氧化,提高葡萄糖氧化在心肌中的能量供给比例,提高心肌供能的效率。常规情况下,心肌细胞处于能量供给处于相对不足状态,而常规心肌60-80%能量供给来源于脂肪酸的氧化,20%~25%为葡萄糖氧化,5%~10% 。虽然每克脂肪酸代谢能产生更多的ATP,但将消耗更多有限的氧,而糖酵解过程氧的利用率高。脂肪酸在缺氧情况下氧化时,将增加乳酸生成,细胞内H+浓度升高,引起细胞内Na+、Ca2+超负荷,加重了细胞损伤,心功能下降;曲美他嗪是抑制了3-KAT,间接刺激了葡萄糖在心肌能量供给中的应用,在从而使在产生同等量ATP的情况下,葡萄糖可直接消耗更小的能量,降低心肌细胞内整个氧化还原反应的活跃程度[17]。动物研究[18]表明,曲美他嗪能够缺再灌注心肌有保护作用,具体可能与其抗氧化机制相关。
参考文献
[1] Bui A L, Horwich T B, Fonarow G C. Epidemiology and risk profile of heart failure[J]. Nat Rev Cardiol,2011,8(1):30~41.
[2] Levy D, Kenchaiah S, Larson M G, et al. Long-term trends in the incidence of and survival with heart failure[J]. N Engl J Med,2002,347(18):1397~1402.
[3] 顾东风,黄广勇,何江,等. 中国心力衰竭流行病学调查及其患病率[J]. 中华心血管病杂志,2003,31(1):3~6.
[4] Stawowy P, Margeta C, Blaschke F, et al. Protein kinase C epsilon mediates angiotensin II-induced activation of beta1-integrins in cardiac fibroblasts[J]. Cardiovasc Res,2005,67(1):50~59.
[5] 刘元生,郭继鸿. 心肌重塑中AT1受体β1受体与PKC和MAPKs信号转导通路间关系的探讨[J]. 中国实用内科杂志,2003,23(8):462~464.
[6] Johnson G L, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science,2002,298(5600):1911~1912.
[7] 冯娟,全雄志,张连峰. 丝裂原活化蛋白激酶和磷酸酯酶-1在心肌病和细胞凋亡中的作用[J]. 中国比较医学杂志,2007,17(9):547~549.
[8] Babbitt C J, Shai S Y, Harpf A E, et al. Modulation of integrins and integrin signaling molecules in the pressure-loaded murine ventricle[J]. Histochem Cell Biol,2002,118(6):431~439.
[9] Antos C L, Frey N, Marx S O, et al. Dilated cardiomyopathy and sudden death resulting from constitutive activation of protein kinase a[J]. Circ Res,2001,89(11):997~1004.
[10] Gorudko I V, Kostevich V A, Sokolov A V, et al. Functional activity of neutrophils in diabetes mellitus and coronary heart disease: role of myeloperoxidase in the development of oxidative stress[J]. Bull Exp Biol Med,2012,154(1):23~26.
[11] Souabni H, Thoma V, Bizouarn T, et al. trans Arachidonic acid isomers inhibit NADPH-oxidase activity by direct interaction with enzyme components[J]. Biochim Biophys Acta,2012,1818(9):2314~2324.
[12] Maack C, Kartes T, Kilter H, et al. Oxygen free radical release in human failing myocardium is associated with increased activity of rac1-GTPase and represents a target for statin treatment[J]. Circulation,2003,108(13):1567~1574.
[13] Byrne J A, Grieve D J, Bendall J K, et al. Contrasting roles of NADPH oxidase isoforms in pressure-overload versus angiotensin II-induced cardiac hypertrophy[J]. Circ Res,2003,93(9):802~805.
[14] Bendall J K, Cave A C, Heymes C, et al. Pivotal role of a gp91(phox)-containing NADPH oxidase in angiotensin II-induced cardiac hypertrophy in mice[J]. Circulation,2002,105(3):293~296.
[15] Ghosh M C, Wang X, Li S, et al. Regulation of calcineurin by oxidative stress[J]. Methods Enzymol,2003,366:289~304.
[16] 牛杏果,赵玉兰. 慢性心力衰竭心肌重塑机制及干预治疗[J]. 心血管病学进展,2005,26(3):281~284.
三、研究内容及研究方案
1. 研究目标、研究内容和拟解决的关键问题;
2. 拟采取的研究方法、技术路线、实验方案及可行性分析、统计学方法;
3. 研究计划及预期研究成果。
一、研究目标
通过建立HF动物模型,根据氧化应激在HF病情发展中的所扮演重要角色,使用曲美他嗪对HF进行干预,评价曲美他嗪对HF的治疗效果,检测NOX以及下游相关分子信号通道活性,明确曲美他嗪作用效果是否与NOX所导致的氧化应激相关,探讨曲美他嗪在阻断氧化应激,治疗HF中的作用机制、作用靶点及途径,为下一步发展HF提供证据。因此,本研究期望达到以下目标:
1、建立动物心衰模型,明确氧化应激核心NOX以及下游MAPKs、Capcase、 MMPs在心肌重构以及HF中所扮演的重要角色。
2、通过曲美他嗪对HF的干预,评价曲美他嗪对逆转心肌重构以及HF的治疗效果
3、评估曲美他嗪对氧化应激通路的影响,明确曲美他嗪在阻断氧化应激途径中的机制、作用靶点以及途径。
二、研究内容
利用腹腔注射异丙肾上腺素方法建立心衰动物模型,利用心脏彩超评估心肌重构情况,利用BNP评估心衰的发展情况,检查并应用逆转录—聚合酶链反应检测心肌细胞中NOX、MAPKs以及Capcase mRNA的表达NOX以及Capcase的活性,明确氧化应激反应与HF发作、心肌重构之间的关系。
通过曲美他嗪治疗HF后,再次评估通过心脏彩超评估心肌重构情况,利用BNP评估心衰的发展情况,并通过检查治疗后细胞中NOX、MAPKs以及Capcase mRNA的表达以及活性,探讨曲美他嗪在抗HF方面机制与氧化应激之间的关系。
三、拟解决的关键问题
1、明确以NOX为核心氧化应激反应在HF的发作中扮演如何的角色
2、探讨通过曲美他嗪是否能够改善心肌能量代谢,从而阻断HF动物心肌细胞中氧化应激反应反应链。
3、探讨曲美他嗪在改善心肌氧耗,阻断氧化应激反应后,是否能够改善HF动物心肌泵功能,
[17] Kantor P F, Lucien A, Kozak R, et al. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase[J]. Circ Res,2000,86(5):580~588.
[18] 葛锦峰,郑世营,赵军,等. 曲美他嗪对离体兔心肌顿抑的保护作用[J]. 中国急救医学,2004,24(12):884~886.
阻止后逆转心脏重构。
四、采取的研究方法
1、构建HF动物模型。通过异丙肾上腺素加快心率,增加心肌能耗,同时使冠状动脉痉挛,建立HF动物模型。
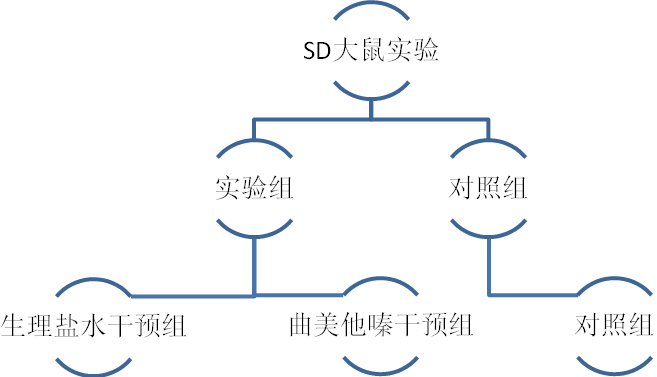
实验动物,12周龄SD大鼠,共有50只,通过计算机随机程序,分为实验组(HF),30只,以及对照组(NC),20只。分笼喂养(每笼为同组的动物5 只),自由摄食饮水。每日早晚喂食,隔日换水。每日明暗时间各为12 h,模拟白天和黑夜,室温控制在23~26℃,湿度50%左右。在实验开始后有2 周的适应期,使动物熟悉环境。经过2周适应期后,予10%水合氯醛(0.1ml/100g)麻醉大鼠后后,予链接心电监护下,HF组给予异丙肾上腺素腹腔注射(5mg/kg?d)×3天,NC组予0.9N.S腹腔注射(2ml/kg?d)×3天,记录给药前后心电图变化。完成给药后第2天,予行眼眶采血,通过外周血清,使用Elisa法检测两组大鼠BNP、肌钙蛋白水平。
2、评估氧化应激途径在HF中的作用。
完成给药后第5周,予行多普勒超声检查,测量两组大鼠左室舒张末期期内径(LVIDd)、收缩末期内径(LVIDs)、左室后壁厚度(LVPW)、室间隔厚度(IVS)以及RR间期,从而推算出左室收缩以及舒张期容积(EDV&ESV)、以及射血分数(EF)。通过计算机随机程序,在每组各抽取10只动物,处死,取出心脏。通过qRT-PCR测定NOX、p38MAPK、Capcase mRNA的表达以及通过Western blot检测其活性。
1)氯化三苯四氮唑(TRC)染色法测定大鼠心肌梗死面积:颈动脉采血后,取出心脏,用滤纸吸干,称重,放置一20℃冰箱,20 min后取出,将心肌均匀切成6~8片,每片厚约1 mm,放置1%TTC磷酸缓冲液中37℃水浴15 min左右。坏死区因、不染色,未坏死区染为红色。标本在4%多聚甲醛中固定24 h后,在显微镜下观察,用图像分析软件分别测定心肌缺血危险区面积和坏死区面积梗死面积大小用梗死区与危险区面积的比值表示。
2)qRT-PCR法检测NOX、p38MAPK、Capcase mRNA表达水平的检测:
采用Tripure分离试剂抽提细胞总RNA,于Beckman D640U 紫外分光光度计下测定RNA纯度,并于1%琼脂糖凝胶电泳(1×TAE 缓冲液)鉴定RNA 完整性。然后定量PCR:反应采用MedProbe公司SYBRGreen I Mastermix于ABI 7700 Sequence DetectionSystem进行。PCR 产物经溶解曲线和琼脂糖凝胶电泳确认特异性聚合酶链反应引物设计及合成,肝x受体a和β引物使用Primer Premier 5 软件自行设计,由上海生工生物技术有限公司合成,序列参考国外同行的资料。
3)estern blot法检测检测NOX、p38MAPK、Capcase mRNA活性:
心肌组织液氮碾磨后,使用放射免疫沉淀测定(RIPA)裂解液裂解组织粉末后经离心收集上清,即为组织蛋白,采用BCA法进行蛋白定量,组织蛋白中按4:1加人5X上样缓冲液,混匀于95℃变
性5~10 min,上样量40 g,10% SDS—page变性分离胶,120 V恒压电泳2 h后,取下胶恒流290 mA转印1.5 h,将转印后0.45 m 聚偏二氟乙烯膜(PVDF)室温封闭1 h,之后分别用NOX、NOX、p38MAPK、Capcase (美国,Invitrogen,工作浓度1:1000)、一抗4℃孵育过夜,回一1抗后用三羟甲基氨基甲烷.盐酸、吐温缓冲液(TBST)洗涤,之后分别用抗兔、抗小鼠二抗(美国,Invitrogen,1:5000)室温孵育1 h,TBST洗涤后滴加ECL发光液于暗室中压片显影,胶片定影后洗净晾干后扫描分析结果。结果用目的条带光密度值与内参条带光密度值的比值表示。
3、给予曲美他嗪治疗HF后,再次评估氧化应激链反应活性、心肌重构以及心功能情况。
余下大鼠,NC组维持不变,HF组分为曲美他嗪干预组(HF-TMZ)以及心衰对照组(HF-NC)。HF-TMZ组予30 mg/(kg?d)灌胃,予组按照同等量0.9N.S.灌胃,持续1月后,期间,每周抽血检查BNP变化。再次按照上文方法,复查心脏多普勒超声后,评估三组动物心功能情况,处死,通过TRC染色法评估三组坏死面积,qRT-PCR法以及Western-blot法检测NOX、p38MAPK、Capcase mRNA的表达以及通过Western blot检测其氧化应激链活性。
4、统计学方法:所有数据用SPSS19统计软件包统计处理。计量资料以x±s表示。用单因
素方差分析进行统计学处理,组间差异采用Student—Newman-Keuls多重比较t检验。以P<0.05为差异有统计学意义。
五、技术路线
六、可行性分析
1、理论上的可行性
本课题前期大量研究证实氧化应激在HF的发病机制中有重要地位。其中NOX酶为核心的氧
化应激机制,是启动下游细胞凋亡、细胞重构的主要部位。结合曲美他嗪具有明确改善心肌能量代谢的作用的基础上,探讨曲美他嗪对于心肌细胞氧化应激机制的干预性,具有明确的理论基础及逻辑推理上的可行性。
2、技术上的可行性
本实验中的心衰模型建立、qRT-PCR以及Weatern-blot等主要技术课题组已经掌握,我院大学城分院的实验室为新建实验室,设施先进、设备齐全,已经通过国家质量体系认证,完全可以保证测定结果的可靠。
3、研究人员的可行性
课题组成员都系统学习过心衰理论,长期关注心衰方面的研究进展,参与多项课题,
包括国家自然基金等课题,能够熟练掌握临床科研工作的方法,课题组人员组成体现了学科
交叉的特点,从而保证了该项目研究的每一个环节都有必要的知识储备;年龄层结构比较合
,在老、中、青协同努力下,能迅速开展科研活动。该项目组具有固定的研究场所,符合
标准的实验室,相对充裕的科研时间,比较畅通的信息渠道,能够完成该项目既定目标。
4、科研管理配套的可行性
大学及医院科研管理部门多年来在科研管理方面积累了丰富的经验,对于科研管理目前已制
定了明确详细的指引,而且定期检查,确保科研工作按时保质的完成。