消化在线: 曲美他嗪对非缺血性心力衰竭的作用研究
来源:
曲美他嗪对非缺血性心力衰竭的作用研究
立论依据
心力衰竭(heart failure,HF)依然是当今世界上人类所面临的主要健康问题之一。尽管目前针对心力衰竭的治疗方法已经取得了极大进展,但其死亡率仍然居高不下,5年内的平均死亡率为50 % [1]。HF发展过程中的一个特点是出现心肌能量代谢异常[2]。实际上,在生理条件下,心肌细胞产生的大多数三磷酸腺苷(ATP)来自于游离脂肪酸(free fatty acid,FFA)的β-氧化;既往研究已发现在心力衰竭进程中伴随与游离脂肪酸利用降低相关的ATP水平的逐渐下降[2,3]。同时作为代偿方式,可能通过活化胎儿基因通路(fetal gene pathways)来增加葡萄糖摄取和利用,以维持正常的细胞功能。在终末期心衰,葡萄糖和游离脂肪酸的利用均出现缓慢下降[4],这反映了一个严重的代谢障碍。
鉴于在HF形成和进展过程中代谢变化的作用,代谢调节疗法成为研究新的HF治疗方案的一个有趣领域。曲美他嗪(Trimetazidine,TMZ)是一个3—酮脂酰辅酶A硫解酶抑制剂,传统上常被用作抗心肌缺血药物,但近年来还用作治疗进展性HF的新选择。虽然其作用机制尚不完全理解,但已证明TMZ能够抑制氧化磷酸化,降低游离脂肪酸氧化,并增加葡萄糖利用与ATP 的产生[5,6]。另外,TMZ还与其他有益的作用有关,如调节心肌中三磷酸腺苷和磷酸肌酸的含量[7,8],降低细胞酸中毒和钙超载[9],并弱化由活性氧物质引起的损伤[10]。
既往大量有关继发于冠状动脉疾病的HF患者研究表明,TMZ具有改善心衰症状和左室射血分数(Left Ventricular Ejection Fractions,LVEF)的作用[11,12],这种影响部分上可以解释为其抗心绞痛作用的结果。最近两个有关心衰患者研究的荟萃分析,其入选研究中的大多数患者的HF继发于冠状动脉缺血,发现曲美他嗪治疗后患者左室射血分数显著改善,且左室舒张末期内径降低,另外,TMZ还与功能状态改善,心脏原因导致的住院率和死亡率降低有关[13,14]。但由Zhang 等报道的实验中,TMZ仅对LVEF的改善有显著作用,而对心室内径或心功能分级则无显著益处[14]。
然而,有关 TMZ对非缺血性HF的作用的研究较少。一项由Fragasso等开展的研究中,包括55例 LVEF<45 %且心功能Ⅱ-Ⅳ级(NYHA分级)的HF患者,其中只有8例有缺血性心肌病[15]。回顾性研究发现,在不考虑HF病因的条件下,服用TMZ 13个月与心功能分级(NYHA分级),LVEF和BNP水平,左室收缩末期体积改善有关。Gunes等研究了87例LVEF≤40%的HF患者,其中包括69 %的缺血性和31 %的非缺血性 HF患者,发现经 TMZ治疗3个月后,患者的LVEF和组织多普勒速度改善[15];而同时患有缺血性HF和糖尿病的患者则显示其LVEF改善更为显著[16]。Tuunanen等人报道的一项小规模研究中,其研究对象为未患糖尿病的非缺血性心衰患者,发现给予患者TMZ 70 mg/d可显著增加其 LVEF[17]。有关TMZ 治疗HF的最大的回顾性分析研究,比较了包括362例HF患者(TMZ+最优标准化治疗)的实验组和307例匹配的对照组, 结果发现TMZ与死亡率降低和较低的心血管疾病住院率与相关[18],在这项研究中20 %的受试者为非缺血性心力衰竭患者。
TMZ上述现象的作用机制可能与游离脂肪酸氧化的抑制有关,但该解释仍存争论。Fragasso等发现,在合并有糖尿病和缺血性心力衰竭的患者, TMZ可显著降低其空腹血糖水平[12],在同一组的另一个临床研究发现,TMZ可改善44例HF患者(多数为缺血性心衰患者)的临床预后,并降低静息能量消耗(通过连续的间接测热法评估)[19],上述结果表明TMZ的作用不完全在心肌组织发挥,也可能在心脏以外的组织中起作用[17]。
另外,在对TMZ治疗非缺血性HF患者的研究中,有数据显示经治疗6个月后,治疗组和对照组间的内皮功能无显著差异,而Park等研究发现,接受TMZ治疗的患者经桡动脉冠状动脉造影显示桡动脉血流介导舒张性显著改善[20,21];该差异可能与两个研究中患者的的内皮功能障碍机制不同有关。
综上所述,有关TMZ对HF的治疗作用,在对缺血性心衰患者研究中发现其作用包括症状改善,左室射血分数提高,和住院率下降;而对非缺血性心衰患者的研究较少,且所得结果尚不一致。本研究假设在标准治疗基础上加用TMZ可改善非缺血性HF患者的临床预后,心肌收缩功能,代谢标志物水平,炎症标志物水平,氧化应激因子水平,和内皮功能。
参考文献
1. Roger VL, Go AS, Lloyd-Jones DM, et al. Heart disease and stroke statisticsd2012 update: a report from the American Heart Association. Circulation 2012;125:e2-220.
2. Neubauer S. The failing heart-an engine out of fuel. New Engl J Med 2007;356:1140-51.
3. Stanley WC, Recchia FA, Lopaschuk GD. Myocardial substrate metabolism in the normal and failing heart. Physiol Rev 2005;85: 1093-129.
4. Taylor M, Wallhaus TR, Degrado TR, et al. An evaluation of myocardial fatty acid and glucose uptake using PET with [18F]fluoro-6-thiaheptadecanoic acid and [18F]FDG in patients with congestive heart failure. J Nucl Med 2001;42:55-62.
5. Allibardi S, Chierchia SL, Margonato V, et al. Effects of trimetazidine on metabolic and functional recovery of postischemic rat hearts. Cardiovasc Drugs Ther 1998;12:543-9.
6. Hamdan M, Urien S, Le LH, Tillement JP, Morin D. Inhibition of mitochondrial carnitine palmitoyltransferase-1 by a trimetazidine derivative, S-15176. Pharmacol Res 2001;44:99-104.
7. Kantor PF, Lucien A, Kozak R, Lopaschuk GD. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase. Circ Res 2000;86:580-8.
8. Rodrigues B, Cam MC, McNeill JH. Myocardial substrate metabolism: implications for diabetic cardiomyopathy. J Mol Cell Cardiol 1995;27:169-79.
9. Lu C, Dabrowski P, Fragasso G, Chierchia SL. Effects of trimetazidine on ischemic left ventricular dysfunction in patients with coronary artery disease. Am J Cardiol 1998;82:898-901.
10. Fantini E, Athias P, Demaison L, Grynberg A. Protective effects of trimetazidine on hypoxic cardiac myocytes from the rat. Fundam Clin Pharmacol 1997;115:427-39.
11. Di NP, Taccardi AA, Barsotti A. Long term cardioprotective action of trimetazidine and potential effect on the inflammatory process in patients with ischaemic dilated cardiomyopathy. Heart 2005;91:161-5.
12. Fragasso G, Piatti Md PM, Monti L, et al. Short- and long-term beneficial effects of trimetazidine in patients with diabetes and ischemic cardiomyopathy. Am Heart J 2003;146:E18.
13. Gao D, Ning N, Niu X, Hao G, Meng Z. Trimetazidine: a metaanalysis of randomised controlled trials in heart failure. Heart 2011; 97:278-86.
14. Zhang L, Lu Y, Jiang H, et al. Additional use of trimetazidine in patients with chronic heart failure: a meta-analysis. J Am Coll Cardiol 2012;59:913-22.
15. Fragasso G, Palloshi A, Puccetti P, et al. A randomized clinical trial of trimetazidine, a partial free fatty acid oxidation inhibitor, in patients with heart failure. J Am Coll Cardiol 2006;48:992-8.
16. Gunes Y, Guntekin U, Tuncer M, Sahin M. Improved left and right ventricular functions with trimetazidine in patients with heart failure: a tissue Doppler study. Heart Vessels 2009;24:277-82.
17. Tuunanen H, Engblom E, Naum A, et al. Trimetazidine, a metabolic modulator, has cardiac and extracardiac benefits in idiopathic dilated cardiomyopathy. Circulation 2008;118:1250-8.
18. Fragasso G, Rosano G, Baek SH, et al. Effect of partial fatty acid oxidation inhibition with trimetazidine on mortality and morbidity in heart failure: Results from an international multicentre retrospective cohort study. Int J Cardiol 2013;163:320-5.
19. Fragasso G, Salerno A, Lattuada G, et al. Effect of partial inhibition of fatty acid oxidation by trimetazidine on whole body energy metabolism in patients with chronic heart failure. Heart 2011;97:1495-500.
20. Park KH, Park WJ, Kim MK, et al. Effects of trimetazidine on endothelial dysfunction after sheath injury of radial artery. Am J Cardiol 2010;105:1723-7.
21. Winter JL, Castro PF, Quintana JC, et al. Effects of trimetazidine in nonischemic heart failure: a randomized study. J Card Fail. 2014 Mar;20(3):149-54.
研究内容及研究方案
1.研究目标、研究内容和拟解决的关键问题;
1.1 研究目标
评估曲美他嗪对非缺血性心力衰竭患者的临床预后,心肌收缩功能,心脏代谢,机体功能,氧摄取,和生活质量的影响。
1.2 研究内容
1.2.1 评估患者的基线值指标;
1.2.2 研究曲美他嗪对非缺血性心衰患者的射血分数,血proBNP水平,运动耐量和生活质量的作用;
1.2.3 研究曲美他嗪对非缺血性心衰患者的葡萄糖,FFA,胰岛素抵抗和心肌18FDG摄取的影响。
1.2.4 观察曲美他嗪对非缺血性心衰患者的血浆儿茶酚胺和氧化应激因子水平的影响;
1.2.5 评价曲美他嗪对非缺血性心衰患者的内皮功能的作用。
1.3 拟解决的关键问题
1.3.1 采用PET评价患者的心肌代谢状态,该技术需经PET培训过专业人员操作,以确保结果的准确性和可信度,我院配有PET-CT,且有经验丰富的专业PET-CT操作人员,具备解决该问题的能力。
1.3.2 患者的随访问题,由于该试验过程持续周期为半年,所以在随访期间可能出现患者死亡或失访等意外现象,本研究在计算样本量过程中已经将其考虑其中,以保障试验顺利完成。
2.拟采取的研究方法、技术路线、实验方案及可行性分析、统计学方法;
2.1 研究方法
2.1.1研究对象
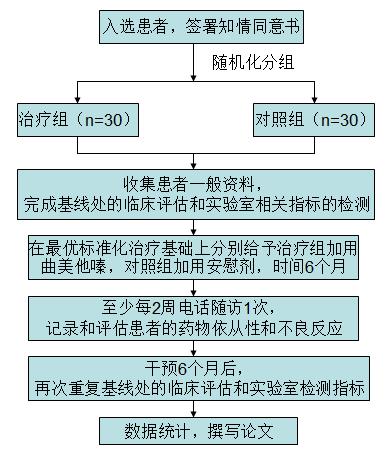
本研究为前瞻性随机双盲研究,拟入选60例于我院就诊的门诊或住院扩张型心肌病(DCM)患者。患者入选条件:(1)心功能II或III级(NYHA)的临床稳定的心力衰竭患者;(2)入选前2周内的放射性造影评价左室射血分数(LVEF)<45%;(3)接受标准药物治疗方案,包括最大耐受剂量的β-受体阻滞剂治疗,血管紧张素转换酶(ACE)抑制剂或血管紧张素Ⅱ受体阻断剂(ARB),螺内酯,利尿剂(若无禁忌);(4)临床稳定性定义为在过去2个月内治疗方案无变化;(5)冠状动脉血管造影结果正常;(6)知情同意书经伦理委员会批准。患者排除条件:(1)心绞痛或心肌梗死史,心电图或体表超声心动图表现有心肌梗死;(2)冠状动脉动脉搭桥术或冠状动脉血管成形术病史;(4)同时患有经标准降压治疗后仍控制不佳的高血压,定义为收缩压>160 mmHg 和/或舒张压>100 mmHg;(5)患有可能会影响氧化应激标志物的全身性疾病,如肿瘤,自身免疫性疾病,肾功能衰竭(血清肌酐>2.5 mg/dL),肝或肺疾病,以及急性或慢性炎症状态。
以随机数字表法将入选患者随机分为2组,治疗组(n=30)和对照组(n=30)。所有入选患者均采用最优标准治疗方案,治疗组在此基础上加用TMZ(20 mg,每日三次),对照组则给予安慰剂,TMZ或安慰剂的治疗时间为6个月。至少每2周进行一次电话随访,记录并评估患者的依从性和不良反应。干预治疗结束后48小时内,重复临床和实验室评估。
2.1.2 评估方法
临床评估包括机体功能和生活质量(明尼苏达心力衰竭生活质量问卷[MLHF])。运动耐量评估:6分钟步行试验评估(6MWT)和测量最大氧耗量的心肺功能试验(Quinton Qplex)。由2位核医学医师采用99Tc放射性同位素心室造影评价左室射血分数。
实验室评估包括血浆pro-b型脑钠肽(NT-proBNP)、肾上腺素、去甲肾上腺素(基线和运动后)、葡萄糖、胰岛素,稳态模型评估( Homeostasis model assessment,HOMA),和血浆游离脂肪酸。氧化应激评估:检测丙二醛(MDA;通过检测硫代巴比妥酸反应物质),超氧化物歧化酶(SOD),和内皮细胞的黄嘌呤氧化酶(eXO:根据基线和肝素静脉推注后之间的血浆酶活性差异进行评估)。全身性炎症标志物:血白细胞计数,红细胞沉降率(ESR),血浆肿瘤坏死因子A,和超敏C反应蛋白。内皮功能的评估:根据目前推荐的超声法检测内皮依赖性(EDDP)和非内皮依赖性(EIDP)的肱动脉扩张率。为了良好的遵守临床实践指南,设立独立安全委员会监测不良事件,并上报至伦理委员会。
2.1.3 经PET的葡萄糖摄取分布
在基线处(干预治疗前)和治疗6个月后,患者接受心脏正电子发射断层扫描(PET),通过64层PET /计算机断层扫描仪以18-氟脱氧葡萄糖(18FDG)用作评价葡萄糖摄取分布。方法:患者口服75克葡萄糖负荷。葡萄糖负荷90分钟后,注射5 mCi 18FDG ,随后60分钟内获取13个心肌动态图像。重建PET图像,采用具有PET处理选项的QPS 2008软件包分析心肌18FDG分布。
左心室(LV)葡萄糖摄取峰值评估采用最大标准摄取值(SUV)由心肌最大放射性浓度(KBQ/g)计算得到, 心肌最大放射性浓度KBQ/g=注射剂量(KBQ)/患者体重(g)。创建极图,使用上述QGS软件包获得不同片段的相对葡萄糖摄取,计算标准节段性FDG吸收量偏差作为心肌代谢异质性指标。
2.3 实验方案及可行性分析
2.3.1 我们在临床工作中已经收集了10例符合本研究的相关患者标本,并按照本研究设计方案进行相关处理,得到初步的数据,说明该试验可行性较好;
2.3.2我院有大量的扩张型心肌病患者,患者资源充足,可确保该试验顺利开展;
2.3.3 本科室长期从事心血管疾病的临床和基础研究工作,对心血管疾病有颇为深入的研究,参与诸多科研项目的丰富经验为本课题的研究奠定了坚实的基础;
2.3.4 我院检验科,超声科,放射科和中心实验室各项设备完善,配有先进的PET-CT,超声设备,及检测血BNP、儿茶酚胺、游离脂肪酸、炎性因子等相关实验条件,各科室技术人员均有多年的相关专业技术经验,可确保实验的顺利进行;
2.3.5 我院有专门的伦理委员会和药品不良反应监督系统,为临床试验合理开展提供了伦理支持和安全保障。
2.4 统计学方法
本研究的主要终点是平均左室射血分数的变化。次级终点包括运动耐量,生活质量,内皮细胞功能,以及心肌葡萄糖摄取。样本量计算:以预期平均LVEF变化为5%,基于既往的缺血性HF临床研究中的LVEF平均变异,检验效能为0.80,双侧α为0.05,所需的患者数量为每组20例。预期损失25 %的患者随访,所以,本研究设计每组30例患者。
所有数据采用统计SPSS19.0软件进行分析。连续变量资料以均数±标准差表示,计数资料以百分比表示(%)。比较正态分布变量采用student-t检验,非正态分布变量间比较采用Mann-Whitney U检验。组间基线值的比较采用配对t检验或Wilcoxon符号秩和检验。
3.研究计划及预期研究成果
3.1 研究计划
2014年5月-2015年5月 入选研究对象,并收集患者一般资料,分组及按流程开始治疗;
2014年5月-2015年11月 对接受治疗的患者进行定期随访,至少每2周进行一次电话随访,记录患者的临床症状;对完成治疗疗程的患者进行第二次检查;
2015年11月-2015年12月 整理数据,撰写论文。
3.2 预期研究成果
我们假设在标准治疗基础上加用TMZ治疗可改善患者临床预后,心肌收缩功能的实验室指标,心肌代谢标志物,炎症标志物,氧化应激因子,和内皮功能。
研究基础
1.申请者与本项目有关的研究工作积累和已取得的研究工作成绩
①前期研究基础:我们在临床工作中已经收集了10例符合本研究的相关患者标本,并按照本研究设计方案进行相关处理,得到初步的数据。同时大量查阅相关文献资料并进行整理。从立题到实验方法、技术路线和实验方案经过反复论证。保证了立题的新颖性、科学性和可靠性。
②扎实的工作基础:本科室长期从事心血管疾病的临床和基础研究工作,对心血管疾病有颇为深入的研究,参与诸多科研项目的丰富经验为本课题的研究奠定了坚实的基础。
③单位领导的支持:医院科研管理规范,单位领导对本课题组的人力、物力给予充分支持。
2.申请者已具备的实验条件、尚缺少的实验条件和拟解决的途径
2.1 已具备的实验条件:我院门诊及住院患者中有大量慢性心力衰竭患者,具备顺利开展该实验的基本条件,我院检验科,超声科,放射科和中心实验室各项设备完善,配有先进的PET-CT,超声设备,及检测血BNP、儿茶酚胺、游离脂肪酸、炎性因子等相关实验条件,可确保实验的顺利进行。
2.2 尚缺少的实验条件:无。
中国医学科学院阜外医院曾彦