消化在线: 曲美他嗪对缺血性心肌病合并肌肉减少症
来源:
曲美他嗪对缺血性心肌病合并肌肉减少症的影响
立论依据
1.1心力衰竭与外周组织代谢异常
心力衰竭是各种心脏疾病的终末阶段,是当今世界最重要的心血管病之一,据世界卫生组织统计,慢性心力衰竭(CHF)已成为世界上最常见的死亡原因之一。流行病学调查显示CHF的发病率随年龄增长呈明显上升趋势[1],严重影响患者的身体健康和生活质量。我国部分地区共42家医院对10714例心力衰竭住院患者的回顾性研究发现,其病因以冠心病居首位[2]。其中40%患者生活质量受到严重影响,30%患者社会功能受限,近一半的患者存在焦虑抑郁等心理障碍。
生物能量饥饿效应是心力衰竭领域的一项新学说。在心力衰竭进展过程中,能量、转移及利用和代谢等方面异常。除了心肌组织,外周组织及其他器官也受代谢异常影响,出现分解-合成代谢失衡,导致组织消耗,最终出现恶病质,而肌肉和脂肪组织的代谢反馈性加重心肌劳损,形成恶性循环。分解代谢的净优势导致心力衰竭患者系统性组织消耗增加,其中骨骼肌消耗是与临床最密切的一个方面,骨骼及脂肪也会受到影响。慢性心力衰竭时骨骼肌氨基酸分解-合成代谢失衡,出现肌肉萎缩,而这一过程早于体重减轻。而通过骨骼肌萎缩,在肺水肿导致呼吸困难的基础上我们可以更好的解释心力衰竭患者的疲劳、运动受限及呼吸困难等症状。上述各种组织消耗最终导致心脏恶病质,越来越多的学者认识到恶病质的重要性,并开始关注其发生机制及治疗措施,而恶病质早期往往不易被察觉,早期干预称为人们关注的重要问题。
根据欧洲心脏病学会[ 3]恶病质可能发生在10%-15%的CHF患者,特别是射血分数降低的患者。这种严重的并发症与严重的症状和功能能力、更频繁的住院、存活率降低有关。几年前,安克认为,恶病质状态是一种很强的心力衰竭死亡率的独立危险因素:在随访中3个月为18%,6个月为29%,12个月为39%,18个月为50% [4]。欧洲临床营养和代谢学会[5]提出恶病质应定义为:a)以慢性疾病为基础,B)非故意体重减轻>5%(或BMI <20千克/平方米),c)至少一种以下条件:肌肉质量和力量降低,乏力,纳差,低瘦肉质量,异常生化(炎症标志物,贫血,白蛋白)。心脏恶病质的患者脂肪组织、瘦肉组织和骨组织减少[6]。代谢疗法不仅可以改善心肌状况,也可影响外周组织,而骨骼肌是机体活动的重要器官,故以骨骼肌影响最大。肌肉质量丢失、体重减轻是恶病质的特点,但在很多缺血性心肌病的患者非脂肪质量下降,而脂肪质量增加,尤其是内脏脂肪质量增加,从而机体体重不变,符合肌肉减少症的特点。因此,恶病质和肌肉减少症之间可能存在重叠。
1.2肌肉减少症
术语“肌症”已经用于描述肌肉结构和功能,该功能的渐进性丧失随着年龄的增加有关。 “肌肉减少症”的起源是来自希腊文的话说,“扎尔克斯”和“减少症”,这意味着“贫穷肉”[7]。后来,老年病学发现,肌肉减少症的定义是不全面的,并建议肌肉减少症的定义应包括目标群体、准则的分类来识别高风险的病人[8]。因此,国际工作组建议统一肌肉减少症的定义。它们定义肌肉减少症为年龄相关的骨骼肌质量和功能下降,可能是由于肌肉废用,激素变化,慢性疾病,炎症,或营养缺乏。因此,老年患者伴体能、力量、整体健康下降的症状,可诊断为肌肉减少症。肌肉减少症的确诊为步速小于1m/ s和低肌肉质量的个体;例如,四肢瘦肉质量相对于身高2在男性小于7.23公斤/平方米和在女性小于5.67公斤/平方米。即使是两个不同的条件下恶病质是作为肌肉减少症的一部分[8]。肌肉减少症中老年人的欧洲工作组(EWGSOP)提出,老年(超过65岁)、低肌肉质量伴低肌力或低的身体活动能力(步行速度≤0.8米/ s),可诊断为肌肉减少症[9]。
骨骼肌肉和力量每年逐渐减少。例如,30岁后骨骼肌量每年下降约1至2%。有报道肌肉质量退化的百分比男性高于女性,下降速率分别为每十年大约12.9%和5.3%[10]。 除了在肌肉质量下降,肌肉力量损失也显而易见。纵向研究表明,在年龄达到70岁以前的老年人以每10年亏损近10-15%的腿部力量,在高龄患者更明显,以每年2?4%的速度增长[10,11] 。而且,肌肉强度减少比肌肉质量的收缩更严重[11,12]。
入院时的持续时间已经显示出与老年人手的握力相关联,具有较强手的握力的患者具住院时间更短[13]。从意大利Sirente地理区域衰老和长寿研究的数据(ilSIRENTE研究)显示,在2年的随访期间肌肉减少症的老年人与无少肌症的人有3倍以上的衰老(falling)风险 [14]。其他研究[15]报道了7年的随访期间少肌症的死亡风险较高,同时股四头肌和握力已被证明与死亡率有关[16]。这些发现强有力的表明,肌肉减少增加了易损性,并导致老年人口的预后不良。
研究人员预测,肌肉减少症的数量将在40年时间增加四倍至200多万[9]。肌肉减少症患者的数目惊人,不仅会影响居民的健康和生活状况,也将增加国家的医疗费用。在2000年,美国医疗保健支出1.5%为肌肉减少症的管理和治疗,约有185亿美元 [17]。经济负担增加,如果肌肉减少症的发生率降低是可能改变的。随着全球人口老龄化漂移,肌肉减少症已成为不能忽视的一大健康问题。因此,努力发现新的干预方法,可同时防止和延缓其发作和肌肉减少症的进展是很重要的。
图1示出了所报告的一些研究,有助于减少症的发病的各种可能的潜在因素。尽管遗传指出,大多数老年化变化是可修改的,并且可以用于预防肌肉减少症。在这些因素中,在老化的氧化应激增加可能更容易调节导致肌肉减少症的一串级联反应。
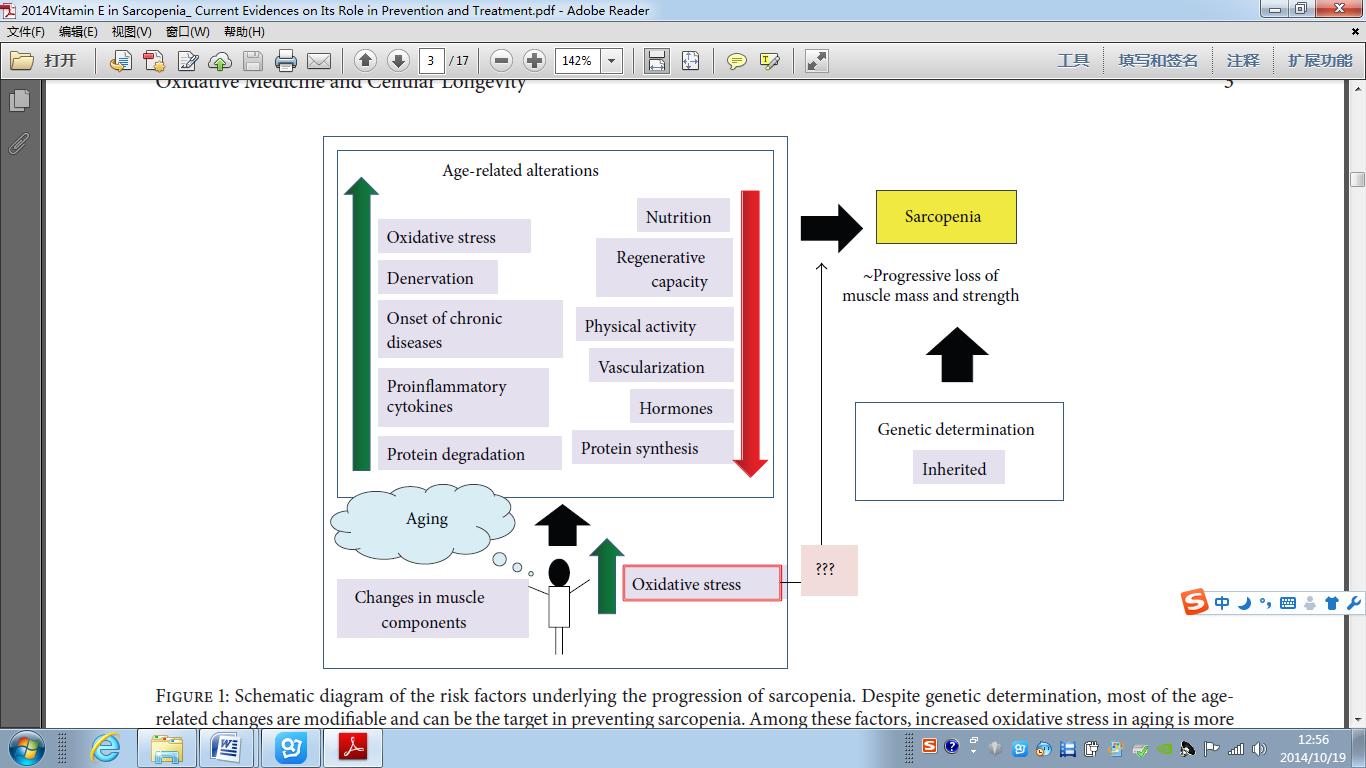
图1:肌肉减少症进展相关风险因素的示意图[18]。
骨骼肌作为身体耗氧量最高的器官是氧化损伤的特殊部位。因此,细胞抗氧化防御系统和肌肉损伤之间具有很密切的相关性。在正常条件下,骨骼肌细胞对氧化应激的抵抗力比其它类型的细胞如成纤维细胞更高。用 150微米的H2O2一次或75μm的过氧化氢两次每两周处理初期的成纤维细胞发展成应激诱导的早衰(SIPS)[19]。 然而,肌细胞早衰的诱导需要更高剂量(1mm)的过氧化氢[41]。这可能表明,骨骼肌具有更多已建立的抗氧化防御系统,其能够结束高水平的活性氧(ROS)。1982年首次报道运动时骨骼肌的活性氧或其他自由基增加 [20]。然而,肌肉长时间制动后活性氧的产生也增加,并引起废用性肌肉萎缩[21]。在这两种情况中观察到的相互矛盾的结果也许可以通过所涉及的不同的机制来解释。例如,不同的强度和ROS产生的持续时间影响最后的结果。骨骼肌在短时间内ROS产生能够激活细胞防御机制,在抗氧化应激中提供进一步保护。然而,通过不同的机制活性氧在很长一段时间大幅增加,从而增加蛋白质的分解代谢和降低细胞的存活,而不是激活的细胞防御机制[22]。导致肌肉萎缩的激活氧化应激过程中发生的蛋白质分解代谢总结于图2。
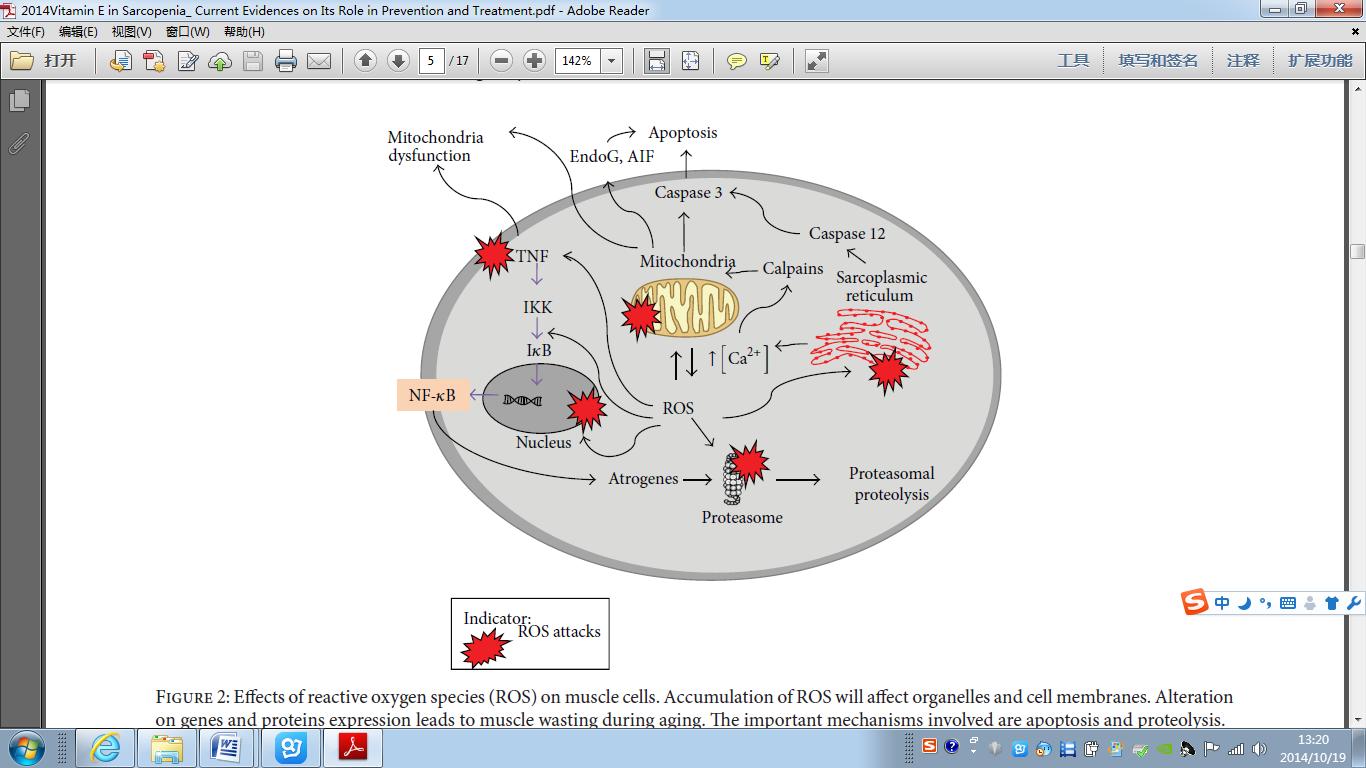
图2:活性氧(ROS)对肌肉细胞的影响[18]。 ROS的积聚会影响细胞器和细胞膜。改变基因和蛋白表达导致肌肉萎缩老化过程。所涉及的重要机制是细胞凋亡和蛋白水解。
阐明肌肉减少症的基本机制可能有助于发现减缓高龄者肌肉质量和力量下降的潜在的干预措施。
1.3曲美他嗪改善能量代谢
血运重建加上正规药物治疗缺血性心肌病型心力衰竭的预后并不理想,5年病死率高达50%以上,并且患者的生活质量很差。代谢调节剂可以减轻疾病早期脂肪酸过多引起的氧化应激,对心力衰竭时合并的肌肉减少症可能是一种有效的预防措施,曲美他嗪是一种优化细胞能量代谢的药物,通过部分抑制耗氧量较多的游离脂肪酸氧化,促进葡萄糖氧化,产生更多ATP,改善心脏的灌注,并防治缺血时酸中毒和钙超载,从而保护细胞膜。曲美他嗪对冠心病心肌缺血及心功能不全患者的保护作用已经得到了证实[23]。
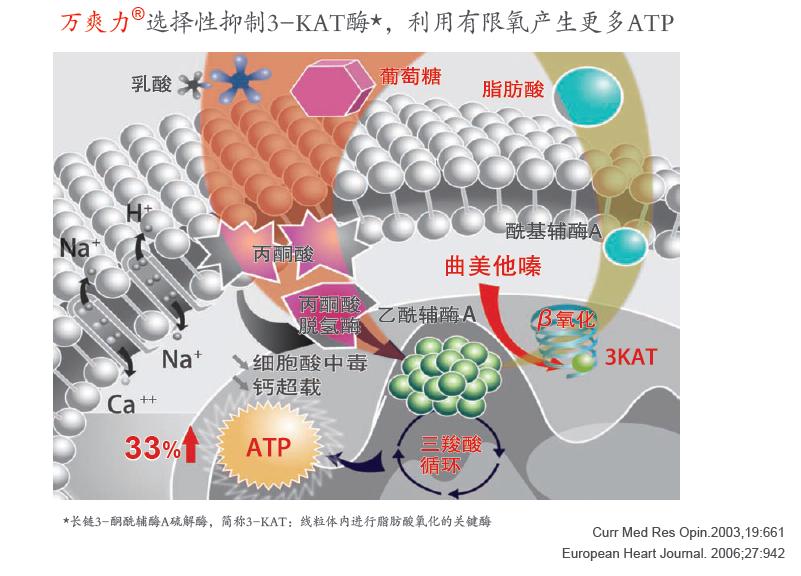
图3曲美他嗪作用机制[24]
一项荟萃分析[25]显示曲美他嗪不仅可以增加左室射血分数和总的运动时间,同时也能减少纽约心血协会的功能分级、左室收缩末期内径、左室舒张末期内径、BNP,曲美他嗪治疗心力衰竭可能减少心因性住院,改善临床症状和心脏功能,同时改善左室重构。
低氧供时,游离脂肪酸和葡萄糖的氧化过程紊乱----反常性的导致与更大的氧耗量相关的游离脂肪酸β氧化率增加----而葡萄糖代谢降低,导致乳酸堆积,并在极限情况下发展为代谢性酸中毒。曲美他嗪通过选择性的抑制酶长链3-酮脂酰酶辅酶A硫解酶,一种游离脂肪酸β氧化途径的关键酶增加葡萄糖代谢率[26]。曲美他嗪亦增加丙酮酸脱氢酶的活性,恢复由缺血导致的葡萄糖氧化和酵解之间的失衡[26-28]。这样就减少了ATP合成过程中的氧耗、氢离子的产生,限制性的增加细胞内酸中毒,降低钙离子积聚。补充能量不足导致的心肌细胞胞质内钠离子的积聚,减少了活性氧(ROS)生成,减少中性粒细胞浸润[29、30],使细胞膜稳定。
曲美他嗪的细胞保护机制[27]:抑制游离脂肪酸分解和刺激葡萄糖分解;减少ATP生成时需氧量;减少乳酸和H+在细胞内积聚;减少Na+和Ca+在细胞内积聚;减少维持离子子平衡的ATP丢失;减少细胞内钙超载产生的不良反应;抗自由基效应;减少心肌缺血再灌注粒细胞浸润;抑制心肌细胞凋亡。
肌肉减少症是个复杂的、多因素参与的过程,只有很少的研究比较年龄相关性肌肉组织学改变,虽有研究表明通过运动、激素替代、某些药物、饮食和营养等可能减缓肌肉减少症的进展,但均尚处于研究阶段。而慢性缺血性心肌病心力衰竭伴随的肌肉减少症的研究在国内外均属空白,曲美他嗪治疗缺血性心肌病的疗效已得到了证实,且已作为缺血性心肌病指南治疗的一线药物,在理论上通过其抗氧化应激作用可能对肌肉减少症有效,对于改善慢性缺血性心肌病患者的生活质量具有重要意义。
参考文献:
1. Lloyd-Jones, D.; Adams, R.J.; Brown, T.M.; et al. Heart disease and stroke statistics-2010 update: a report from the American Heart Association. Circulation,2010 121, e46-e215.
2. 中华医学会心血管病学分会.中国部分地区1980、1990、2000年慢性心力衰竭住院病例同顾性调查[J]中华心血管病杂志,2002,30:450454.
3. McMurray, J.J. Adamopoulos, S. Anker, S.D. et al. ESC Committee for Practice Guidelines.Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012.Eur. Heart J., 33, 1787-1847.
4. Anker, S.D. Ponikowski, P. Varney, S. et al.Poole-Wilson,P.A. and Coats, A.J.S. (1997) Wasting as independent risk factor for mortality in chronic heart failure. Lancet, 349(9058), 1050-1053.
5. Muscaritoli, M. Lucia, S. Molfino, A. et al . Muscle atrophy in aging and chronic disease: is it sarcopenia or cachexia? Int. Emerg. Med.2012, DOI 10.1007/s11739-012-0807-8
6. Anker, S.D.; Steinborn W. and Strassburg S. Cardiac cachexia. Ann. Med.2004, 36(7), 518-529.
7. I. H. Rosenberg, “Sarcopenia: origins and clinical relevance,”The Journal of Nutrition, vol. 127, no. 5, pp. 990S–991S, 1997
8. R. A. Fielding, B. Vellas, W. J. Evans et al., “Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences. International working group on sarcopenia,” Journal of the American Medical Directors Association, vol. 12, no. 4, pp. 249–256, 2011.
9. A. J. Cruz-Jentoft, J. P. Baeyens, J. M. Bauer et al., “Sarcopenia: European consensus on definition and diagnosis,” Age and Ageing, vol. 39, no. 4, Article IDafq034, pp. 412–423, 2010.
10. V. A. Hughes, W. R. Frontera, M. Wood et al., “Longitudinal muscle strength changes in older adults: influence of muscle mass, physical activity, and health,” The Journals of Gerontology A: Biological Sciences and Medical Sciences, vol. 56, no. 5, pp. B209–B217, 2001.
11. B. H. Goodpaster, S. W. Park, T. B. Harris et al., “The loss of skeletal muscle strength, mass, and quality in older adults: the Health, Aging and Body Composition Study,” Journals of Gerontology A: Biological Sciences and Medical Sciences, vol. 61,no. 10, pp. 1059–1064, 2006.
12. W. R. Frontera,K. F.Reid, E. M. Phillips et al., “Muscle fiber size and function in elderly humans: a longitudinal study,” Journal of Applied Physiology, vol. 105, no. 2, pp. 637–642, 2008.
13. V. Keevil, R. M. Razali, A.-V. Chin, K. Jameson, A. A. Sayer, and H. Roberts, “Grip strength in a cohort of older medical inpatients in Malaysia: a pilot study to describe the range, determinants and association with length of hospital stay,”Archives of Gerontology and Geriatrics, vol. 56, no. 1, pp. 155–159, 2013.
14. F. Landi, R. Liperoti, A. Russo et al., “Sarcopenia as a risk factor for falls in elderly individuals: results fromthe ilSIRENTE study,” Clinical Nutrition, vol. 31, no. 5, pp. 652–658, 2012.
15. F. Landi, A. J. Cruz-Jentoft, R. Liperoti et al., “Sarcopenia and mortality risk in frail olderpersons aged 80 years and older: results from iLSIRENTE study,” Age and Ageing, vol. 42, no. 2,pp. 203–209, 2013.
16. A. B. Newman, V. Kupelian, M. Visser et al., “Strength, but not muscle mass, is associated with mortality in the health, aging and body composition study cohort,” Journals of Gerontology A: Biological Sciences andMedical Sciences, vol. 61, no. 1, pp. 72–77,2006.
17. I. Janssen, D. S. Shepard, P. T. Katzmarzyk, and R. Roubenoff,“Thehealthcare costsof sarcopenia intheUnitedStates,” Journal of the American Geriatrics Society, vol. 52,no. 1, pp. 80–85, 2004.
18. Khor SC, Abdul Karim N, Ngah WZ,et al. Vitamin E in Sarcopenia: Current Evidences on Its Role in Prevention and Treatment. Oxid Med Cell Longev. 2014;2014:914853. doi: 10.1155/2014/914853. Epub 2014 Jul 6.
19. Q. M. Chen, K. R. Prowse, V. C. Tu, S. Purdom, and M.H. K. Linskens, “Uncoupling the senescent phenotype from telomere shortening in hydrogen peroxide-treated fibroblasts,” Experimental Cell Research, vol. 265, no. 2, pp. 294–303, 2001.
20. K. J. A. Davies, A. T. Quintanilha, G. A. Brooks, and L. Packer, “Free radicals and tissue damage produced by exercise,” Biochemical and Biophysical Research Communications, vol. 107, no. 4, pp. 1198–1205, 1982.
21. H. Kondo, M. Miura, and Y. Itokawa, “Oxidative stress in skeletalmuscle atrophied by immobilization,” Acta Physiologica Scandinavica, vol. 142, no. 4, pp. 527–528, 1991.
22. L. L. Ji,M.Gomez-Cabrera, and J.Vina, “Exercise and hormesis:activation of cellular antioxidant signaling pathway,” Annals of the New York Academy of Sciences, vol. 1067, no. 1, pp. 425–435, 2006.
23.C.-J. Liu and N. K. Latham, “Progressive resistance strength training for improving physical function in older adults,”Cochrane Database of Systematic Reviews, vol. 3, no. 3, Article ID CD002759, 2009.
24. Fundamental & Clinical Pharmacology.2003;17:133
25.Zhang L, Lu Y, Jiang H, et al. Additional Use of Trimetazidine in Patients With Chronic Heart Failure : a meta-analysis. J Am Coll Cardiol. 2012 Mar 6;59(10):913-22.
26. Fantini E, Demaison L, Sentex E, Grynberg A, Athias P. Some biochemical aspects of the protective effect of trimetazidine on rat cardiomyocytes during hypoxia and reoxygenation. J Mol Cell Cardiol. 1994;26:949–58.
27. Kantor PF, Lucien A, Kozak R, Lopaschuk GD. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondriallong-chain 3-ketoacyl coenzyme A thiolase. Circ Res.2000;86:580–8.
28. Banach M. The role of trimetazidine in the treatment of heart diseases. Poznan: Termedia Publishing House; 2006.
29. Parang P, Singh B, Arora R. Metabolic modulators for chronic cardiac ischemia. J Cardiovasc Pharmacol Ther. 2005;10:217–23.
30. Kowalski J, Pawlicki L, Baj Z, Pas ′nik J, Olejniczak J. Effect of trimetazidine on biological activity of neutrophils in patients with transient myocardial ischemia induced by exercise testing. Pol Merkuriusz Lek. 2000;9:548–51.
研究内容及研究方案
(一)研究目标
1.研究曲美他嗪长期应用对于缺血性心肌病的作用
2.研究曲美他嗪长期应用是否可以预防及改善肌肉减少症
(二)研究内容
第一部分(临床试验)
1.临床患者募集及分组
入选慢性缺血性心肌病患者并除外其他明显影响试验结果的因素如严重呼吸、肝肾等疾病,将患者分为长期应用曲美他嗪组及非长期应用曲美他嗪组,其中非长期曲美他嗪治疗组如符合肌肉减少症标准继续试验,分为曲美他嗪治疗组及常规治疗组。
2.观察指标
选取患者基本资料、临床资料、肌肉质量、握力、6分钟步行试验及生活质量评分。
3.回顾性研究
经初级入选标准入选缺血性心肌病患者后,长期曲美他嗪治疗组与非长期曲美他嗪治疗组回顾病史并进行各项观察指标比较,并分别算出两组间发生肌肉减少症的发病率。
4.前瞻性对照研究
从初级入选标准入选的非长期应用曲美他嗪患者经二级入选标准筛选出肌肉减少症患者,随机分为曲美他嗪组及常规治疗组。曲美他嗪组在原基础治疗方案上加用曲美他嗪长期口服,常规治疗组继续目前治疗方案,至研究终点比较上述监测指标。
第二部分(动物试验)
1.构建缺血性心肌病动物模型
选择试验动物,确定饲养及分组方法,经基线配对分为治疗组及对照组,均采用心脏原位结扎法制造心肌缺血模型。
2.药物干预措施
治疗组造模同时给予曲美他嗪药物灌胃治疗,对照组给予等体积生理盐水灌胃。
3.评估运动功能、心功能、组织病理学
造模4周后应用动物实验跑台比较两组间运动时间及运动距离,用心脏彩超比较两组间心功能,4周处死后采用病理切片观察下肢腓肠肌肌纤维形态,同时测定腓肠肌蛋白含量。
(三)拟解决的关键问题
1. 恶病质和肌肉减少症在心力衰竭患者存在重叠,根据患者症状和体征、物理检查及功能性检查识别肌肉减少症,及早给予干预措施、指导治疗,提高患者的运动耐力,增强患者独立自主的生活能力,改善患者的焦虑状态,提高生活质量。
2. 随着AHA、ESC各种心衰指南及我国心力衰竭治疗指南的发布,关于心力衰竭的药物治疗、生活方式干预有明确的指导,且在降低缺血性心肌病住院率及死亡率同时,改善患者的生活质量亦成为人们关心的问题。曲美他嗪在改善心因性住院率的同时,对肌肉减少症的作用是本实验的研究目的,且对于老化导致的肌肉减少症亦可能有预防及治疗作用。
(四)研究方法
第一部分(临床试验)
1.临床患者募集及分组
1.1入选标准
(1)初级入选标准:缺血性心肌病患者,心力衰竭病史2年及以上,心功能II、III级;同时满足超声心动图左室射血分数<50%;
(2)二级入选标准:骨骼肌相对指数及四肢骨骼肌质量相对于身高2在男性<7.23kg/m2,在女性<5.67kg/m2,伴肌力减低或步速<1m/ s。
1.2排除标准
(1)存在水肿;(2)运动受限、装有义肢者;(3)对曲美他嗪过敏或不能耐受;(4)合并恶性肿瘤、不可控制的肝、肾、肺功能障碍患者。
1.3分组方法
(1)根据有无长期应用曲美他嗪(1年及以上)将入选患者分为长期应用曲美他嗪组及非长期应用曲美他嗪组。
(2)非长期应用曲美他嗪组根据二级入选标准后继续进行试验,经临床基线资料匹配后分为曲美他嗪组及常规治疗组。曲美他嗪组在原基础治疗方案上加用曲美他嗪长期口服,常规治疗组继续目前治疗方案。
2.观察指标
2.1基本资料:性别、年龄、体重指数、烟酒史、既往病史。
2.2临床资料:肌酐、尿素、总蛋白、白蛋白、血红蛋白、糖化血红蛋白、总胆固醇、甘油三酯、血压、抗血小板药物、利尿剂、醛固酮受体拮抗剂、ACEI/ARB、硝酸酯类药物、他汀类药物、β受体阻滞剂、洋地黄、补钾类药物、曲美他嗪。
2.3肌肉质量测定:应用双能X线骨密度检测仪(法国MEDILNK公司数字化双能X线骨密度仪)及生物电阻抗法(BIA)(清华同方BCA-1A人体成分分析仪)测定患者的骨骼肌质量,应用骨骼肌质量(kg)/身高2(m2)得出骨骼肌相对指数,在男性<7.23kg/m2,在女性<5.67kg/m2。
2.4握力测定: 应用WCS-100型电子握力测试仪,按下电子握力测试仪开关键开机,释放按键后,仪器显示0.0,即可进入状态。受试者测试时,身体直立,两脚自然分开(同肩宽),两臂自然下垂,开始测试时,用最大力紧握上下两个握柄,用力握把,此时液晶显示屏上的数据开始刷新显示,直至不再有新的测量峰值出现为止,即可读取测量数据。测试两次,取最大值,记录以千克为单位,保留小数点后一位。
2.5 6分钟步行试验:步行路线为30米长的走廊。走廊的长度每3米处要有标记。折返处应有锥形标志,出发线为出发点和每个60米的终点,用明亮的颜色条带标于地面上。实验前患者准备:a.穿着舒适;b.穿适于步行的鞋子;c.患者试验过程中应使用平时步行时使用的辅助物(拐杖、助步器等);d.患者平时的治疗方案要继续;e.试验前饮食应清淡;f.试验前2个小时内患者应避免过度运动。患者应在试验开始位置附近坐在椅子上休息至少10分钟。在此期间,检查是否存在禁忌症,测量脉搏、血压。实验开始后于每分钟计时、并记录患者行走距离。根据步行距离及时间计算患者步速。
2.6生活质量评分:采用《明尼苏达心力衰竭生活治疗调查表》。
3.回顾性研究
经初级入选标准入选缺血性心肌病患者后,长期曲美他嗪治疗组与非长期曲美他嗪治疗组回顾病史并进行各项观察指标比较,并分别算出两组间发生肌肉减少症的发病率。
4.前瞻性对照研究
从初级入选标准入选的非长期应用曲美他嗪患者经二级入选标准筛选出肌肉减少症患者,随机分为曲美他嗪组及常规治疗组。曲美他嗪组在原基础治疗方案上加用曲美他嗪长期口服,常规治疗组继续目前治疗方案,至研究终点比较上述监测指标。
第二部分(动物试验)
1.构建缺血性心肌病动物模型
1.1试验动物、饲养及分组
选取清洁级4-8周龄Wistar雄性大鼠40只,体重200-250g(由辽宁本溪辽宁长生生物技术有限公司提供),于哈医大一院动物试验中心以4只/笼分笼饲养,保持通风、环境温度22±2℃及12小时昼夜节律,试验动物可自由取水及进食。根据体重、心功能及运动能力等基线资料匹配分组为治疗组(20只)及对照组(20只)。
1.2缺血性心肌病模型制作
采用心脏原位结扎法:乙醚麻醉大鼠,仰卧位固定,胸部剪毛,碘酒-酒精消毒皮肤。用气管插管连接微型人工呼吸器,行体表心电图监测。在胸骨左侧与胸骨平行作一纵行切口,切开皮肤及胸大肌,暴露肋骨。在距胸骨约0.5cm外剪断第5、6肋软骨,打开胸腔,剪开心包,暴露心脏。轻压胸廓将心脏挤出胸腔外。用小弯针穿000000号丝线,从肺动脉圆锥左缘进入,从此进入点和左心耳根部联线的中间穿出,连同穿过的心肌一起结扎。结扎部位大约距左冠状动脉开口下1mm。结扎后将心脏放回胸腔。心电图监视判定结扎成功后,缝合胸壁、皮肤。撤掉气管插管及心电。在结扎的当时心电图即显示急性缺血改变,如II导R波高尖、ST段抬高、Q波出现和加深等。
2.药物干预措施
2.1治疗组
用0.9%氯化钠注射液悬混曲美他嗪(施维雅公司),配成1mg/ml悬浊液,给予大鼠以10 mg/kg/日(约2ml)1次/日灌胃。
2.2对照组
给予1mg/kg/日0.9%氯化钠注射液1次/日灌胃。
3.评估运动功能、心功能、组织病理学
3.1运动功能测定
试验前及造模4周后应用电刺激动物实验跑台,设定斜坡坡度40°,每次刺激时间在2s、刺激频率4次/min,以10m/min速度运动,至力竭计算运动时间及运动距离。
大鼠运动力竭的表现:在运动过程中,不能维持原强度工作,当降低运动强度或短时间休息后(一般为10min以内,多为5分钟)大鼠仍不能恢复运动能力为力竭。大鼠表现为表情冷漠,反应迟钝,卧位跑,腹部与跑道面接触,将大鼠从跑台内取出时,大鼠基本无逃避反应。
3.2心功能测定
试验前及造模后4周行心脏彩超检查(Sonos 7500 Phillips),检测左室收缩期末径(LVSD)、左室舒张期末径(LVDD)、室间隔厚度(IVS)、左室后壁厚度(LVW)及左室射血分数(EF)。
3.3骨骼肌病理及组织检测
造模后4周处死动物,采用组织切片技术观察骨骼肌形态,取上段腓肠肌用滤纸吸干组织表面血液,经OCT包埋后放入液氮-70℃冷冻储存,取出后用冰冻切片机(德国徕卡仪器有限公司)切片进行HE染色。每张切片选择5个视野,用光学显微镜(OLYMPUS)拍摄肌纤维形态,用图像分析软件Image J计算肌纤维横截面积(CSA)。用预冷生理盐水洗净下段腓肠肌血液后称重、匀浆,用Eppendorf Bio Photometer Plus核酸蛋白测定仪德国测试蛋白质含量。
(六)可行性分析
1.理论可行性:慢性心力衰竭患者的生活质量越来越受到人们的关注,影响患者生活质量的原因除了呼吸困难外,尚有字体活动受限,生物能量饥饿效应是心力衰竭领域的一项新学说。慢性心力衰竭时骨骼肌氨基酸分解-合成代谢失衡,出现肌肉萎缩,而这一过程早于体重减轻,故早期干预成为心力衰竭能量代谢治疗的重点及难点。肌肉减少症定义为年龄相关的骨骼肌质量和功能下降,其原因除可老龄化外,还与慢性心力衰竭等疾病相关。曲美他嗪是一种优化细胞能量代谢的药物,其对冠心病心肌缺血及心功能不全患者的保护作用已经得到了证实,Khor等证明抗氧化剂Vit E可以预防肌肉萎缩及促进肌肉再生,我们推测通过其抗氧化作用考虑曲美他嗪可能改善慢性心力衰竭患者骨骼肌的能量代谢,从而提高骨骼肌质量及强度。
2.方法可行性:课题组所在单位具有开展本研究所需的一切仪器设备及患者来院。拟采用的所有实验手段和技术,均为课题组成员所熟悉和掌握。
3.安全性:曲美他嗪已作为一种优化细胞能量代谢性药物长期应用于临床,其安全性已得到了证实。
4.人员可行性:项目申请人高宇囡医师为主治医师、讲师,在心力衰竭及能量代谢的研究方面有一定建树。课题组成员均为本教研室教师和研究生,他们不但是具有多年临床工作经验的医生,还具有丰富的基础研究经历,这些人员构成能完全能满足开展实验的要求。
(七)统计学方法
应用 SPSS18.0 统计软件进行数据处理,计数资料应用χ2检验,计量资料以均数±标准差表示,同一患者前后对照及动物试验用配对t检验,两组间患者比较采用独立样本t检验,p<0.05为差异有统计学意义。
研究基础
研究者毕业于吉林大学医学院,毕业后于哈尔滨医科大学附属第四医院心内科工作多年,具有丰富的临床工作经验,曾在国家核心期刊发表论文多篇,并参与国自然一项(心肌缺血再灌注损伤相关)。
1、高宇囡、张尉华、佟倩.联合检测脑钠肽、超敏C反应蛋白及D二聚体对急性心肌梗死的临床价值,中国实验诊断学,第13卷,第8期,1032-1035页,2009
2、寇世杰、高宇囡、佟倩.主动脉夹层动脉瘤的诊断与治疗,吉林医学,第30卷,第4期,289-291页,2009
3、高宇囡、杨茂、陈延军et al.阿托伐他汀序贯治疗对行急诊PCI的急性心梗患者心功能的影响,哈尔滨医科大学学报, 第46卷,第4期,360-363页,2012
4、孙丽秀、支继新、 高宇囡、 刘俊艳、 李学奇.rhBNP对心力衰竭合并肾功能不全的临床疗效观察,现代生物医学进展, 第13 卷,第25期,4877-4880页,2013.
项目申请人所在单位哈尔滨医科大学附属第四医院是三甲级医院,心脏中心为省级重点实验室,目前承担多项省级及国家级课题,发表医学论文200余篇,其中SCI收录文章达30余篇。所处地区为心血管病高发地区,缺血性心肌病心力衰竭发病率高。医院有双能X线骨密度检测仪(法国MEDILNK公司数字化双能X线骨密度仪)及生物电阻抗分析仪(BIA)(清华同方BCA-1A人体成分分析仪)等设备,心血管内科具有可进行6分钟步行实验的场所。
上述工作条件,完全能满足开展本项目所需的全部实验技术要求。
高宇囡