消化在线: 曲美他嗪抑制急性心肌梗死自噬信号通路
来源:
曲美他嗪抑制急性心肌梗死自噬信号通路作用和机制研究
立论依据
1.研究意义
急性心肌梗死(acute myocardial infarction, AMI)是全球人群死亡的主要原因之一1。尽管AMI治疗手段迅速发展——主要是及时的再灌注治疗——从根本上改善了急性冠状动脉综合征患者的预后。但很大部分AMI事件发生于院外,患者多因诸多原因无法及时到达医院,错过开通梗塞血管的最佳时机。且在医疗资源匮乏的偏远地区,开展再灌注治疗也成为一个难题。如何在AMI时减轻梗死灶周围心肌细胞的死亡,缩小心肌梗死面积,尽可能的保护心脏功能具有重要意义。近期研究发现,自噬(cell autophagy)导致的细胞凋亡是AMI时梗死灶周围心肌细胞死亡的方式之一。是否能够通过调节AMI时梗死灶周围心肌细胞自噬,减轻梗死灶周围心肌细胞的死亡,缩小心肌梗死面积,具有重要的意义,调控心肌细胞自噬可能成为进一步改善梗死后心脏功能和降低AMI死亡率的潜在靶点之一2-4。
2.国内外研究现状及发展动态分析
细胞自噬作用是真核细胞中一种高度保守的降解过程,其主要的生理功能是在胞质内形成双层膜结构,包裹部分胞质和细胞内需降解的细胞器、蛋白质,与溶酶体融合后分解产生氨基酸、核苷酸及ATP,以实现营养物质的再循环,从而维持细胞自身稳定5-8。
目前研究认为,自噬是一种防御和应激调控机制。在心肌细胞这种高度分化的细胞中,它通过降解功能异常或错误折叠的蛋白质以及受损或老化的细胞器,能够促进细胞物质循环,完成细胞的自我更新2。但自噬不足或过度均可能引起细胞凋亡。能量供应不足、炎症、缺血缺氧、再灌注损伤等应激情况,均可调节心肌细胞表现出自噬特性,但自噬在这些情形下的功能并无定论。研究发现,通过下调Beclin1表达或者使用3-甲基腺嘌呤(3-methyladenine,3-MA)抑制自噬,可以减少经过缺氧/复氧(anoxia/reoxygen,A/R)处理后的心肌细胞死亡9,10。Aki等发现无糖培养的心肌细胞自噬增强同时细胞死亡增加,3-MA抑制自噬后可以减少心肌细胞的死亡也提示了自噬可能会导致心肌细胞死亡11。但亦有很多文献报导细胞自噬在AMI中发挥保护作用。研究发现,缺血预处理(ischemic preconditioning, IPC)可以诱导自噬,从而减轻随后持续缺血导致的损伤,如果抑制自噬,可以消除IPC的心肌保护作用12。另外,也有文献报道了他汀类药物通过在AMI时上调心肌自噬的水平减小心肌梗死范围,从而产生保护作用13。故自噬是在AMI疾病进程中是一种潜在的存活机制还是导致细胞凋亡的病理性机制,或者在AMI疾病过程中不同阶段具有不同的作用,都有进一步研究的需求。
细胞自噬的诱导与调节是一个复杂的信号调控过程(见图1)。研究发现,心肌缺血时可诱导心肌细胞自噬,其主要的调节途径有:1.哺乳动物雷帕霉素靶蛋白(manmalian target of rapamycin,mTOR)信号通路14:mTOR有2个蛋白复合体,TORC1和TORC2。TORC1是雷帕霉素的靶蛋白,营养充足的情况下,TORC1被激活而抑制自噬,当营养缺乏时,TORC1被抑制而激活细胞自噬。文献报道,TORC1可以通过募集自噬相关蛋白(autophagy related protein,Atg)家族蛋白,形成Atg1-Atg13-Atg17复合物来上调组织自噬水平。同时,TORC1也可以通过作用其下游靶蛋白(如Tap42)的磷酸化,来调节自噬。在真核生物中,TOR蛋白不仅接受细胞营养环境的调控,同时可以接受胰岛素受体,胰岛素受体底物1、2,PtdIns3k、PDK1等物质水平的影响。2.AMPK通路8,14:由于心肌细胞缺血缺氧,胞内ATP/AMP比值下降,通过LKB1活化AMP激活蛋白激酶(AMP-activated protein kinase,AMPK),AMPK激活后可通过多条途径激活自噬,其主要通过磷酸化真核细胞延伸因子-2(eukaryotic elongation factor 2,eEF2)来促进自噬,亦可通过调节mTORC1 的亚基Raptor 的磷酸化而抑制mTORC1的活性,最终激活自噬;3.通过Bnip3通路调节14:Bnip3 是促细胞凋亡Bcl-2家族BH3-only亚家族的成员,它与Bcl-XL竞争结合Beclin-1导致beclin-1 被活化后,募集Atg家族蛋白Atg12-Atg5-Atg16 复合物,形成前自噬泡,并进一步募集微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)结合到分隔膜,同时导致Atg12-Atg5-Atg16 复合物脱落,产生成熟的自噬体,诱发细胞产生自噬。
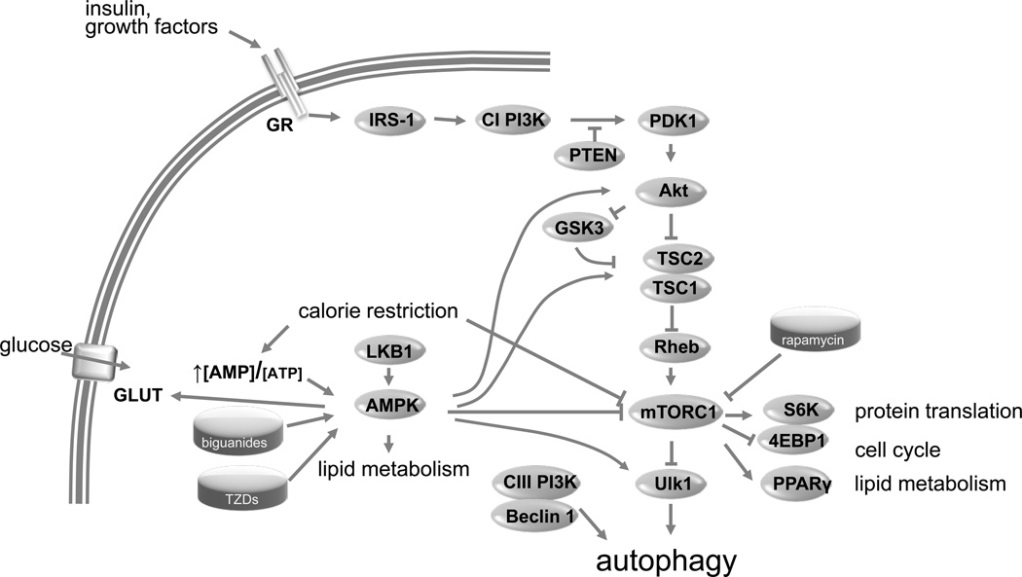
图1.心肌细胞自噬的主要信号调控过程
针对不同靶点选择性地应用心肌细胞自噬调节剂为疾病的治疗提供了新的思路。曲美他嗪(Trimetazidine,TMZ)是临床常用的心脏保护类药物,TMZ通过选择性抑制长链3-酮脂酰-辅酶A硫解酶(long chain 3-ketoacyl-CoA thiolase)以及直接刺激丙酮酸脱氢酶(pyruvate dehydrogenase),使心肌能量代谢从脂肪酸氧化转为葡萄糖氧化从而发挥心肌保护的作用。因此,TMZ能够使心肌细胞中ATP保持在一定的水平,从而产生心肌保护作用。同时研究发现,TMZ具有强大的抗氧化活性15,可以减轻自由基引起的心肌损伤,调节炎症反应最终减少心肌坏死面积。在缺血再灌注情况下,曲美他嗪能防止线粒体膜通透性急剧增加、减少中性粒细胞的激活,同时减少心肌细胞的凋亡比率16-18。综上所述,缺血缺氧时心肌细胞内ATP/AMP比值下降,通过AMPK激活后可激活自噬是影响自噬的经典途径。既往研究发现,曲美他嗪能够使心肌细胞中ATP保持在一定的水平,从而产生心肌保护作用。但TMZ是否通过调节细胞自噬在AMI模型中发挥保护心肌的作用并无文献报道。故我们提出研究假说:AMI时给予曲美他嗪干预,可能通过上调ATP/AMP比值,通过AMPK通路来抑制梗死灶周围心肌细胞自噬的表达,从而减轻梗死灶周围心肌细胞的死亡,缩小心肌梗死面积。
本项目拟通过给予TMZ干预离体大鼠心肌细胞缺氧模型和在体大鼠心肌梗死动物模型,通过电镜观察梗死灶周围心肌细胞自噬的表达,并检测自噬标记物LC3-II、Beclin1及AMPK通路上各个环节蛋白表达的变化,探讨TMZ对梗死灶周围心肌细胞自噬的作用和机制。
3.应用方向或应用前景:
针对不同靶点选择性地应用心肌细胞自噬调节剂为疾病的治疗提供了新的思路。如果心肌梗死时给予TMZ干预,能够通过AMPK通路来抑制梗死灶周围心肌细胞自噬的表达,进而降低AMI后心肌细胞死亡。本项目将为进一步改善梗死后心脏功能和降低AMI死亡率提供新理论和新靶点,为未来指南的修订提供数据。
References:
1.Mendis S, Chestnov O. The global burden of cardiovascular diseases: a challenge to improve. CurrCardiol Rep. 2014;16:486.
2.Dhesi P, Tehrani F, Fuess J, Schwarz ER. How does the heart (not) die? The role of autophagy in cardiomyocytehomeostasis and cell death. Heart Fail Rev. 2010;15:15-21.
3.Rabkin SW. Nitric oxide-induced cell death in the heart: the role of autophagy. Autophagy. 2007;3:347-349.
4.Takagi H, Matsui Y, Sadoshima J. The role of autophagy in mediating cell survival and death during ischemia and reperfusion in the heart. Antioxid Redox Signal. 2007;9:1373-1381.
5.Saito S, Nakashima A. A review of the mechanism for poor placentation in early-onset preeclampsia: the role of autophagy in trophoblast invasion and vascular remodeling. Journal Of Reproductive Immunology. 2014;101-102:80-88.
6.Cherra SR, Dagda RK, Chu CT. Review: autophagy and neurodegeneration: survival at a cost? NeuropatholApplNeurobiol. 2010;36:125-132.
7.Rami A. Review: autophagy in neurodegeneration: firefighter and/or incendiarist? NeuropatholApplNeurobiol. 2009;35:449-461.
8.Vicencio JM, Galluzzi L, Tajeddine N, Ortiz C, Criollo A, Tasdemir E, et al. Senescence, apoptosis or autophagy? When a damaged cell must decide its path--a mini-review. Gerontology. 2008;54:92-99.
9.Matsui Y, Takagi H, Qu X, Abdellatif M, Sakoda H, Asano T, et al. Distinct roles of autophagy in the heart during ischemia and reperfusion: roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy. Circulation Research. 2007;100:914-922.
10.Valentim L, Laurence KM, Townsend PA, Carroll CJ, Soond S, Scarabelli TM, et al. Urocortin inhibits Beclin1-mediated autophagic cell death in cardiac myocytes exposed to ischaemia/reperfusion injury. Journal Of Molecular And Cellular Cardiology. 2006;40:846-852.
11.Aki T, Yamaguchi K, Fujimiya T, Mizukami Y. Phosphoinositide 3-kinase accelerates autophagic cell death during glucose deprivation in the rat cardiomyocyte-derived cell line H9c2. Oncogene. 2003;22:8529-8535.
12.Gurusamy N, Lekli I, Gorbunov NV, Gherghiceanu M, Popescu LM, Das DK. Cardioprotection by adaptation to ischaemia augments autophagy in association with BAG-1 protein. J Cell Mol Med. 2009;13:373-387.
13.Araki M, Motojima K. Hydrophobic statins induce autophagy in cultured human rhabdomyosarcoma cells. BiochemBiophys Res Commun. 2008;367:462-467.
14.Yang Z, Klionsky DJ. An overview of the molecular mechanism of autophagy. Curr Top MicrobiolImmunol. 2009;335:1-32.
15.Maridonneau-Parini I, Harpey C. Effect of trimetazidine on membrane damage induced by oxygen free radicals in human red cells. Br J ClinPharmacol. 1985;20:148-151.
16. Williams FM, Tanda K, Kus M, Williams T (1993) Trimetazidine inhibits neutrophil accumulation after myocardial ischaemia and reperfusion in rabbits. J CardiovascPharmacol 22: 828–833
17. Tritto I, Ambrosio G (2005) The antianginal drug trimetazidinereduces neutrophilmediated cardiac reperfusion injury. J CardiovascPharmacol 46:89–98
18.Ruixing Y, Wenwu L, Al-Ghazali R (2007) Trimetazidine inhibits cardiomyocyte apoptosis in a rabbit model of ischemia- reperfusion. Transl Res 149:152–160
研究内容及研究方案
1.研究目标
a)探索TMZ是否通过AMPK通路来抑制梗死灶周围心肌细胞自噬的表达,进而减轻梗死灶周围心肌细胞的死亡,缩小AMI大鼠心梗面积和降低AMI死亡率。
b)探索AMI后,自噬信号通路变化的作用和机制,以及如何调节产生保护AMI后心肌细胞作用与功能。
2.研究内容
a)为探索TMZ是否通过AMPK通路来抑制梗死灶周围心肌细胞自噬的表达,进而减轻梗死灶周围心肌细胞的死亡,缩小AMI大鼠心梗面积和降低AMI死亡率:我课题组以离体大鼠心肌细胞缺氧模型和在体大鼠心肌梗死动物模型为研究对象,通过给予TMZ干预,采用电镜观察膜状结构的自噬体以及其他相关亚细胞结构,在蛋白水平检测自噬标记物LC3-II、Beclin1、及AMPK通路上各个环节的蛋白表达,同时在体大鼠心肌梗死动物模型中,观察AMI大鼠存活率和生存时间、心肌病理形态学改变、梗死区心肌细胞存活率和死亡率的影响。以证明TMZ通过AMPK通路来影响心肌细胞自噬的表达。
b)探索AMI后,自噬信号通路变化的作用和机制,以及如何调节产生保护AMI后心肌细胞作用与功能:AMI后,自噬信号通路如何变化并不清楚,通过该研究,一方面发现急性心梗后自噬信号通路的调节作用和机制,另一方面探索如何调控自噬信号通路,保护心肌以防进一步损伤,降低和减轻急性心梗后的心脏损伤,以降低急性梗的死亡率和致残率,补充和完善急性心梗后保护作用。为进一步探索急性心梗治疗新靶点和新方法提供理论依据。
3.拟解决的关键问题
a)验证TMZ是否通过AMPK通路来抑制梗死灶周围心肌细胞自噬的表达,从而减轻AMI后梗死灶周围心肌细胞死亡是本研究拟探索的第一个也是最重要的科学问题。为研究该科学问题,我们首先以离体大鼠心肌细胞缺氧模型为研究对象,使用4,5-二甲基-2-噻唑基(2,5-diphenyltetrazolium bromide, MTT)法检测细胞生存率,比较各组细胞在缺氧环境下生存率变化,同时采用电镜观察膜状结构的自噬体以及其他相关亚细胞结构,在蛋白水平检测自噬标记物LC3-II、Beclin1、及AMPK通路上各个环节的蛋白表达。同时建立在体大鼠心肌梗死动物模型为研究对象,采用各种技术手段,检测上述相同的指标,互为验证来回来这个问题。
b)回答TMZ干预是否可以缩小AMI大鼠心梗面积和降低AMI死亡率是本研究拟探索的第二个科学问题。为回答该问题,我课题组给予TMZ干预在体大鼠心肌梗死动物模型,观察AMI大鼠存活率和生存时间、心肌病理形态学改变、梗死区心肌细胞存活率和死亡率的影响,结合第一个科学问题,试图回答TMZ基于心肌细胞自噬通路对AMI梗死灶周围心肌细胞保护的影响和作用机制。
4.研究方法及实验手段:
a)实验设计:
本课题科研设计依循随机、对照和重复三大原则,采用组间对照和干预前后组内对照进行统计学分析。
b)实验材料:
i.实验动物:SPF级6周龄Wistar雄性大鼠50只,体重200-250g,北京斯贝福有限公司提供(实验动物许可证号:SYXK京2005-0019)。
ii.实验分组:离体大鼠心肌细胞缺氧模型分3组,包括:正常对照组、渥曼青霉素组(细胞自噬抑制剂组),和TMZ干预组。在体大鼠心肌梗死动物模型(每组10只)分4组,包括:正常对照组、假手术组、渥曼青霉素组(细胞自噬抑制剂组),和TMZ干预组。
c)主要试剂及试剂盒:
1)DMEM/F12(GIBCO,美国)
2)胎牛血清(GIBCO,美国)
3)胰蛋白酶(Invitrogen,美国)
4)PBS磷酸盐缓冲液(Hyclone,美国)
5)MTT(GIBCO,美国)
6)MDC(monodansylcadaverine, MDC, Sigma,美国)
7)HBSS(Hank’s balanced salt solution, GIBCO,美国)
8)RNA提取试剂盒(Omega,美国)
9)PrimeScript II 1st Strand cDNA synthesis Kit(Takara,日本)
10)LC3I\II、Atg5抗体(Cell signaling technology,美国)
11)Beclin1、BNIP-3抗体(Santa Cruz biotechnology,美国)
12)Hoechst 33258凋亡试剂盒(Beyotime institute of biotechnology,日本)
13)BCA蛋白定量试剂盒(博士德,中国)
14)PDVF纤维膜(Sigma,美国)
d)主要仪器和设备
1)Vivid7 小动物超声心动仪(GE Healthcare,英国)
2)NIS-ELEMENTS定量分析软件(Nikon,日本)
3)JEM-1230投射电镜(Nikon,日本)
4)BiofugeStratos型低温高速台式离心机(Heraeus,德国)
5)微量移液器(Eppendorf,德国)
6)DGX-9073B-1型电热鼓风干燥箱(福玛,上海)
7)RM2245型病理切片机(Leica,德国)
8)HI1220型烘片机(Leica,德国)
9)BX-51型光学显微镜(Olympus,日本)
10)DYY-7B型转移电泳仪(六一仪器厂,北京)
11)WD-9412A型恒温循环器(六一仪器厂,北京)
12)MDF-U50V型-80℃超低温冰箱(SANYO,日本)
13)KG19V21型-20℃冰箱(Siemens,德国)
14)lightcycler 2.0型Real-Time RT-PCR仪(Roche,瑞士)
15)DU800型核酸蛋白分析仪(Bechman Coulter,美国)
16)电泳装置(Bio-Rad,美国)
上述仪器设备均由教育部和北京市共建心血管重塑重点实验室(首都医科大学附属北京安贞医院)提供。
5.技术路线及关键技术
a)技术路线:
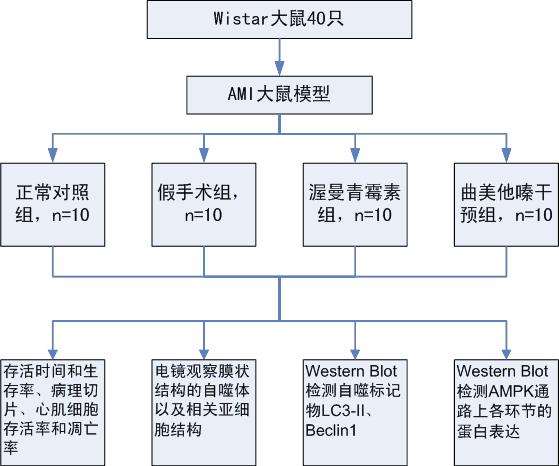
b)关键技术:
i.离体研究:
分离1-2日龄Wistar乳鼠心肌细胞,按照常规进行原代培养,做以下检测:
1)4,5-二甲基-2-噻唑基(2,5-diphenyltetrazolium bromide, MTT)法检测细胞生存率:按照实验设计,对照组,渥曼青霉素组(200nM,根据文献设定浓度),和TMZ组(根据预试验设定浓度),药物预处理1h,至于缺氧孵箱中分别缺氧0h,0.5h,1h,3h,6h。MTT比色法,使用分光光度计侧吸光度,比较各组细胞在缺氧环境下生存率变化。
2)凋亡检测:将乳鼠心肌细胞接种于激光共聚焦小皿,按照实验设计,对照组,渥曼青霉素组(200nM,根据文献设定浓度),和TMZ组(根据预试验设定浓度),药物预处理1h,至于缺氧孵箱中分别缺氧0h,0.5h,1h,3h,6h。用Hoechest33258染核,检测细胞凋亡率。
3)细胞自噬检测:将乳鼠心肌细胞接种于激光共聚焦小皿,按照实验设计,对照组,渥曼青霉素组(200nM,根据文献设定浓度),和TMZ组(根据预试验设定浓度),药物预处理1h,至于缺氧孵箱中分别缺氧0h,0.5h,1h,3h,6h。使用单丹硫酰尸胺(monodansylcadaverine, MDC)染色后用激光共聚焦检测其荧光信号,定量分析自噬活性。同时,将细胞用胰酶消化、离心后用戊二醛固定,电镜检测膜状结构的自噬体以及其他相关亚细胞结构。同时提取细胞总蛋白,用免疫印记(western blot)检测自噬标记物LC3-II、Beclin1等的表达。
ii.大鼠AMI模型的建立和鉴定:
按照Pfeffer等报道的大鼠急性前壁心肌梗死模型方法造模(Circ Res. 1979;44:503-512)。取250~300g Wistar大鼠,2%戊巴比妥钠0.3ml/kg的比例进行腹腔注射。气管插管后连接小动物呼吸机。如果3次都没有插管成功,就应放弃该鼠。呼吸机设置为容量控制模式,潮气量为10mL/kg体重,呼吸频率为45~50次/分,吸呼比为1:2,通气频率为55-60次/分,通气量为潮气量3ml/100g。同时连接生理记录仪进行心电监测,记录十二导联心电图,选择胸前导联作为监测导联。大鼠取右侧卧位,备皮,上界为上肢到脊柱的连线,下界为肋骨最下端到脊柱的连线。在大鼠的身下放置小电热毯,消毒铺单后,以心尖搏动最强的点为中心,作一横行切口,长度前后距胸骨和脊柱各1cm,在切口下方,鼠的身体下垫一个小纱布卷,依次切开皮肤、深浅筋膜,钝性分离胸大肌和前锯肌,显露肋骨,充分止血后,由第4肋间入胸。用乳突牵开器牵开肋骨,撕开靠中部心包,由于下方垫的纱布卷,当心包撕开后,心尖即向上方翘起,用镊子掀开左心耳,从左心耳下方2~3mm进针,缝扎的中点在左心耳和肺动脉圆锥的交界和心尖连线上,缝扎的方向应和左心耳的边缘平行,以5-0或6-0的无损伤缝合线进行缝扎,进针深度1.5mm左右结扎。观察心脏运动一小段时间,约5min左右,如果结扎区域变白,运动减弱,同时两个以上肢体导联或胸导出现ST段抬高0.2mV以上提示结扎成功后逐层缝合关胸,在大鼠腹腔内注入40万单位青霉素以预防感染。大鼠在手术后应置于小电热毯上,上方用台灯照射以保温。
iii.免疫组化检测检测蛋白表达:
石蜡切片脱蜡至水,蒸馏水洗3遍后进行抗原修复:1x柠檬酸置压力锅中,盖上锅盖,扣上压力阀,大火加热至沸腾喷气,开始计时,1min 30s后关闭电源,稍置数分去阀开盖,室温放置自然冷却后取出。滴加过氧化物酶阻断剂(3%双氧水),室温15 min ,PBS洗3min x3次。血清封闭,室温20min。甩片后直接加稀释待检测的一抗,4℃湿盒过夜。过夜后室温静置30min,PBS洗3min x3次。加二抗,室温孵育20min,PBS洗3min x3次后使用DAB显色:1ml蒸馏水+A液,B液,C液各1滴,显微镜控制显色时间,水洗。采用CMIAS2001 B图像分析软件测量光密度值。
iv.Western Blot 检测蛋白表达:
提取心肌组织总蛋白,使用BCA试剂盒蛋白定量后分装。取上清进行聚丙烯酰胺凝胶电泳,将电泳分离后的蛋白质电转移至硝酸纤维素膜上,经封闭、洗脱后分别加入待检测蛋白的一抗及β-actin一抗孵育4h,洗膜后再用辣根过氧化物酶标记的二抗孵育1h及洗膜。Odyssey双色红外激光成像系统检测蛋白。以目的蛋白与内参吸光度积分比值的变化作为蛋白水平的变化。
6.可行性分析
(1)方法可行性:本研究采用的细胞和动物模型均为国际通用的经典模型,其建模和鉴定方法,本课题组人员在前期承接的北京市自然基金项目中已完全掌握。
(2)实验条件可行性:课题组所在单位具备开展本研究的设备仪器,为本课题基础实验研究提供了设备保障和技术支持。
(3)有一定前期实验基础:本研究前期发现TMZ具有对AMI大鼠模型有抗氧化应激和心肌保护作用。能抑制AMI表达,为本研究深入探索提供了坚实的实验基础。
(4)有高效、优秀的研究团队:本课题负责人刘文娴长期从事AMI临床和科研工作。承担了2项省级课题。1项北京市自然基金。发表论文40余篇。课题组成员朱佳佳、任燕龙长期从事AMI科研工作,有丰富的AMI动物实验技术。有1名博士和1名硕士参加本研究,课题组有能力完成本实验。
7.预期结果:
首次证实曲美他嗪通过抑制AMPK通路来降低AMI时梗死灶周围心肌细胞自噬的表达,进而减轻梗死灶周围心肌细胞的死亡,缩小AMI大鼠心梗面积和降低AMI死亡率。
研究基础
基金主要申请者:刘文娴
首都医科大学附属北京安贞医院心内科CCU病区,主任医师
教育背景
1987年首都医科大学医学系毕业获学士学位
2003年首都医科大学临床医学内科学获硕士学位
工作经历
本人于1987年分配到安贞医院工作,1992年晋升为主治医师,1998年晋升为副主任医师。2003年晋升为主任医师。曾于2002年到比利时列日大学中心医院、美国休斯敦St. Luke医院进修学习。目前任心内科CCU主任,负责监护病房CCU日常工作,曾多次成功指导危重病人的抢救。主要专业特长是冠心病的临床及介入治疗,危重患者的救治以及心力衰竭的系统治疗等。目前的研究方向主要是冠心病危重症的救治及抗凝问题、慢性心力衰竭的综合治疗等。
发表文章_(第一作者及通讯作者)
1. Pan QR#, Ren YL#, Zhu JJ, Hu YJ, Zheng JS, Fan H, Xu Y, Wang G, Liu WX*. Resveratrol increases nephrin and podocin expression and alleviates renal damage in rats fed a high-fat diet. Nutrients. 2014 Jul 14;6(7):2619-31.
2.宁尚秋,刘文娴,陈立颖,康铁朵,李江,马长生,吕树铮。心脏介入治疗术并发急性心脏压塞的临床分析。中华急诊医学杂志,2011,20(9):999-1001
3.赵晗,刘文娴。非ST段抬高急性冠脉综合征患者血浆NT-ProBNP与GRACE危险分层的关系。心肺血管病杂志,2011,30(2):111-115
4.刘文娴,张维君,张丽洁。重症心血管疾病医学研究生教学的探索与实践[J]。中国医药,2010;5(12):1186-1187
5.张静,刘文娴。慢性心力衰竭教育管理的现状与发展[J]。心肺血管病杂志,2010;29(4):352-354
6. 刘文娴,符岚,杨鲲,盛瑾,陈立颖,宁尚秋,吕飙,戴沁怡,毕涛。静脉推注美托洛尔在冠状动脉CT检查中的应用[J]. 医药导报,2007,(6):629-630
7.刘文娴,吕树铮,陈立颖,卢燕玲。高龄急性冠脉综合征患者血运重建问题初探[J]. 中华急诊医学杂志,2004,(8):545-547
8.刘文娴,吕树铮,陈立颖,卢燕玲. 高龄冠心病患者完全和不完全血运重建对疗效的影响[J]. 中国循环杂志,2004,(3):172-174
9.刘文娴,吕树铮,宋现涛,陈韵岱,陈立颖,卢艳玲. 冠心病多支血管病不同治疗方法的疗效分析[J]. 心肺血管病杂志,2003,(2):86-88
10.刘文娴,吕树铮,宋现涛,陈韵岱,柳弘,陈立颖,卢艳玲,陈欣,田锐,张金荣. 左主干病变不同治疗方法的疗效分析[J],中国介入心脏病学杂志,2003,(2)
11.刘文娴,吕树铮,宋现涛,陈韵岱,陈立颖,卢艳玲,冠心病多支血管病变的不同治疗方法的疗效分析[J].心肺血管病杂志,2003,(2):86-88
12.刘文娴,吕树铮,陈立颖,柳弘,陈韵岱,血浆尿酸水平与冠心病的关系[J].中国介入心脏病学杂志,2000,(3)
13.刘文娴,张金荣,糖尿病合并冠心病患者的冠脉造影分析[J].中国糖尿病杂志,1999,(1):22-24
14.刘文娴,张桂珍,张纯,朱小玲,耿世钊,吕树铮,张金荣,脉冲式多普勒超声心动图检测肺静脉血流与左室舒张压的相关性研究[J].中国介入心脏病学杂志,1998年,(1)
15.刘文娴,吴学思,吕树铮,平板运动试验中T波改变的观察[J].心肺血管病杂志,1997,(1)
16.刘文娴,106例平板运动试验结果分析[J].综合临床医学,1997,(6)
17. 赵晗,刘文娴. 急性冠状动脉综合征患者血浆NT-proBNP水平与冠状动脉病变严重程度的关系[J]. 心肺血管病杂志. 2011(06)
18. 宁尚秋,刘文娴,陈立颖,康铁朵,李江,董建增,任学军,马长生,吕树铮. 心房颤动射频导管消融术并发急性心脏压塞九例临床分析[J]. 中国全科医学.2011(05)
19.宁尚秋,刘文娴,陈立颖,康铁朵,李江,杨鲲,马长生,吕树铮. 经皮冠状动脉介入治疗并发急性心脏压塞的临床分析[J]. 心肺血管病杂志. 2011(03)
20. 李鹏,刘文娴,张丽洁,辛毅. 氯吡格雷对人早期内皮祖细胞黏附、迁移及增殖功能的影响[J]. 新乡医学院学报. 2012(03)
21. 慈维苹,刘文娴,李鹏,盛瑾. 晚期内皮祖细胞对共培养心肌细胞功能的影响[J]. 心肺血管病杂志. 2012(03)
22. 杨鲲,刘文娴,任伟. 造影剂肾病临床相关因素分析[J]. 心肺血管病杂志. 2012(05) 560-564
23. 宁尚秋, 刘文娴, 杨鲲,陈立颖, 康铁朵, 李江, 朱佳佳,马长生,吕树铮.雷帕霉素洗脱支架与紫杉醇洗脱支架在急性心肌梗死直接经皮冠状动脉介入治疗中的疗效比较[J]. 临床荟萃2012(08)
24. 李江,刘文娴,赵一楠, 任燕龙.替格瑞洛在治疗氯吡格雷抵抗患者时血小板聚集率分析[J]. 中国全科医学 2014(19)
25. 李江,刘文娴,朱佳佳,康铁朵,宁尚秋,陈立颖,盛瑾. 血栓抽吸导管在治疗冠状动脉支架血栓时的作用分析[J]. 中国医药 2013(11)
26. 张宁,刘文娴.血浆N末端脑钠肽前体联合全球急性冠状动脉事件注册评分建立非ST段抬高型急性冠状动脉综合征临床风险预测模型的研究[J]. 中国医药 2014(3)
27.李江,朱佳佳,康铁朵,宁尚秋,杨鲲,盛瑾,陈立颖,刘文娴. 依诺肝素联合替罗非班治疗急性心肌梗死的有效性与安全性分析[J].心肺血管病杂志 2013(2)
2.工作条件
(1)本项目课题组所在的北京安贞医院在心血管疾病的诊断和治疗方面有雄厚的实力;
(2)所依托的首都医科大学是北京市重点高等院校,学科力量雄厚,科研实力强,在校本部和附属医院建有一批国家级和市级重点学科和重点实验室,本实验中所涉及的组织学、免疫组织化学和细胞生物学实验依托我院基础医学实验室和校开放实验室完成,实验室建设拥有十分优良的实验室条件,具备完成本课题所需要的大部分实验设备,如流式细胞仪、细胞培养设备、荧光显微镜、倒置相差显微镜等;
(3)在前期工作的基础上,具备基础研究细胞培养、RT-PCR、Western-Blot、免疫组化实验技能,为下一步的实验研究进行提供有力技术保障。
刘文娴首都医科大学附属北京安贞医院