消化在线: 糖尿病心肌损伤的新机制——心肌细胞内
来源:
糖尿病心肌损伤的新机制——心肌细胞内肌浆网钙转运ATP酶小泛素样修饰的研究
立论依据
1. 研究意义
随着社会经济发展与生活方式变化,中国疾病发生与流行形势正在进入一种新的模式,面临慢性病高患病率和致死率的双重挑战。糖尿病正是这种流行病学转型过程中重要而典型的病种。我国糖尿病发病率由上世纪80年代的0.84%增至2008年的9.7%,30年间增加了近10倍[1],随着人口老龄化的进展,这一情况在大中城市显得更为严峻。糖尿病并发症是糖尿病致死、致残的决定性因素。根据我国2001年对11个省级城市卫生经济学调查表明,治疗2型糖尿病及其并发症的直接医疗总费用为187.5亿元,占卫生总费用3.94%.其中81%的费用用于治疗与2型糖尿病相关的并发症[2];而近十年来,对糖尿病并发症的治疗费用仍在持续攀升,给国家和家庭带来了沉重的经济负担,严重阻碍了社会、经济的发展。
心血管疾病作为糖尿病尤其是2型糖尿病最常见的并发症和致死原因,是糖尿病并发症防治过程中的重点和难点。2型糖尿病又被称为冠心病的等位病症,不过即使在冠状动脉未受累的情况下,糖尿病本身也同样可以对心肌造成损伤,形成糖尿病心肌病。随着近几十年来冠脉介入等技术的发展与成熟,糖尿病并发冠心病的患者治愈率和存活率显著升高,生命周期延长,使得糖尿病对心肌损伤的时间也延长;糖尿病心肌损伤并最终导致心力衰竭成为糖尿病心血管病并发症防治过程中的突出问题。本项申请立足于我国公共卫生现状,从临床出发提出科学问题,并进行有针对的基础研究,其目的在于阐明糖尿病心肌损伤这一复杂病理生理过程及其分子机制,为临床上延缓甚至阻断糖尿病引起心衰进展提供新的思路和方法;并通过强化和提高转化医学研究效率,为最终解决糖尿病心肌损伤这一公共卫生及经济社会问题提供助力。
2. 国内外研究现状分析
2.1. 能量代谢失衡是糖尿病引起心肌舒张功能不全的重要因素
糖尿病心肌损伤的显著特点是以舒张功能不全为首发表现[3],并逐渐引发收缩功能不全,最终发展为心力衰竭[4]。临床研究很早就发现,2型糖尿病患者心肌舒张功能受损出现在心肌肥厚之前;胰岛素抵抗和血糖水平与心肌舒张功能不全直接相关[5-7]。心肌细胞发生胰岛素抵抗后,出现葡萄糖代谢减少,脂肪酸代谢增多的能量代谢失衡[8];近些年的基础研究提示,心肌细胞能量代谢失衡(糖代谢减少,脂肪酸代谢增多)与舒张功能不全以及心力衰竭的进展密切相关[8],其具体机制主要有:①葡萄糖代谢的减少会影响细胞离子平衡和内质网钙泵的功能[8, 9];而脂肪酸代谢增多有可以通过Randle cycle进一步减少葡萄糖的代谢从而使舒张功能下降[8, 10]。②氧气利用效率降低:产生相同量的ATP,心肌细胞使用脂肪酸作为底物进行能量代谢要比使用葡萄糖消耗更多的氧气;尤其在心肌缺血情况下,脂肪酸代谢增多可以加重缺血对心肌细胞的损伤,促进心肌细胞肥大[11, 12]。③心肌细胞内脂肪酸代谢增多会削弱线粒体氧化能力,并促进大量活性氧(ROS)的生成以及细胞凋亡[3]。总之,心肌细胞内的葡萄糖和脂肪酸的代谢失衡是引发舒张功能不全并逐渐发展为心力衰竭的重要因素。
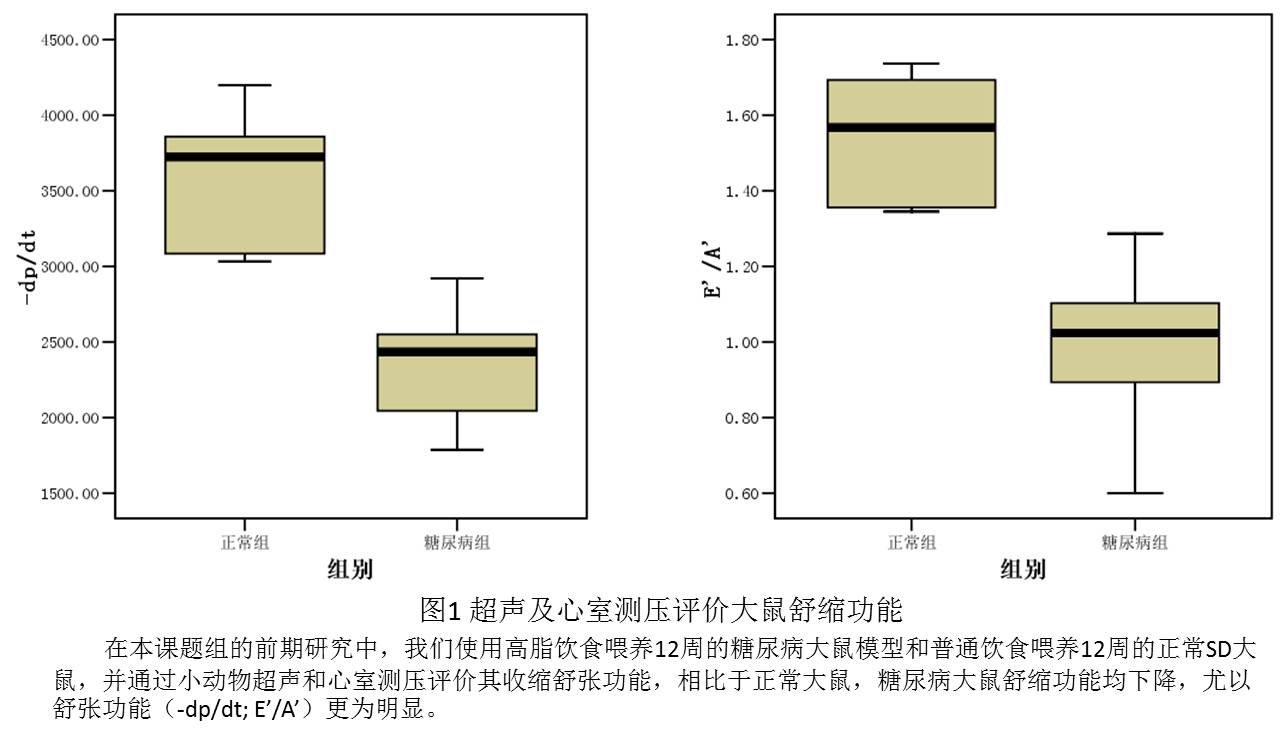
2.2. 心肌细胞内肌浆网钙转运ATP酶(SERCA)的蛋白水平和活性下降是糖尿病引起心肌主动舒张功能的关键因子
糖尿病对心肌舒张功能的损害体现在心肌僵硬度增加和心肌主动舒张受限两个方面,其中心肌组织纤维化程度加剧引起的心肌组织僵硬度增加已经被认识多年[13]。糖尿病减弱心肌细胞的主动舒张能力,在整体水平上表现在舒张期压力下降速率-dp/dt降低以及二尖瓣环舒张早晚期速率比E’/A’降低(见图1所示),其主要机制是舒张期心肌细胞胞质Ca2+浓度升高[14]。本课题组也发现1型糖尿病大鼠心肌组织纤维增生,心脏-dp/dt降低以及经二尖瓣血流速率比E/A升高[15-17]。多个糖尿病模型动物已经证实心肌细胞内肌浆网钙转运ATP酶(Sarcoplasmic Reticulum Calcium-Transporting ATPases;SERCA)活性和表达下降是糖尿病心肌细胞Ca2+稳态失衡的主要原因[18],提高糖尿病心肌病大鼠模型中心肌细胞内SERCA的表达,可以大幅改善大鼠的心功能[19]。在既往研究中提示了一些糖尿病引起SERCA下降的原因[20, 21],但这些原因都并不足以彻底阐明其下降的机制。SERCA有三大类异构体(SERCA1、SERCA2和SERCA3),SERCA2作为最主要的异构体同样含有三种异构(SERCA2a、SERCA2b和SERCA2c),其中SERCA2a是心肌细胞中最主要的异构体[22]。近年来,众多研究证实心肌细胞高表达SERCA2a后,可以增加冠脉血流量[23];减少心肌梗死的梗死面积,提高心衰大鼠心功能和存活率[24];降低缺血再灌注及心力衰竭等病理生理过程中心律失常的发生率[25, 26];同时还可以改善糖尿病心肌病大鼠的心功能[19]。
2.3. 小泛素样修饰可以调节SERCA2a的蛋白水平与活性
SERCA2a经典的调控途径是:磷酸受纳蛋白(phospholamban, PLB)与之结合后会抑制其活性,当PLB磷酸化程度增高时,它对SERCA2a的抑制作用则会降低;心肌细胞内有多条通路都是通过调节PLB磷酸化程度和表达量从而调节SERCA2a[22]。2011年Kho[27]等在Nature杂志上首次报道了SERCA2a新的调控方式:小泛素样蛋白1(small ubiquitin-like modifier protein 1, SUMO1)可以修饰SERCA2a,并提高其表达量、稳定性和ATP酶活性;该研究同样发现:⑴心衰病人及心衰猪模型的心肌细胞SUMO1、SERCA2a以及与SUMO1结合的SERCA2a含量下降;⑵增加心肌细胞SUMO1的表达,使被SUMO1修饰的SERCA2a增多,可以改善心功能,降低心衰动物的死亡率。小泛素样修饰作为SERCA2a的一种新的调控方式,与糖尿病之间的联系目前鲜有报道,亟待更加广泛而深入的研究。
小泛素样蛋白(SUMO蛋白)与小泛素样修饰(sumoylation):小泛素样蛋白属于泛素超家族中的一员,最初由Mahajan[28]发现,并于1997年首次在Cell杂志上报道,随着其他SUMO蛋白的被发现,此蛋白随后被命名为SUMO1。目前被发现的的SUMO蛋白有4种,长度均为100个氨基酸左右[29];小泛素样修饰属于蛋白质翻译后修饰,近十几年来才逐渐被认识;该修饰的过程是通过一系列依赖ATP的酶促反应将SUMO蛋白结合在目的蛋白上:首先sentrin-specific proteases(SENPs)将SUMO蛋白C末端切除,再由激活酶E1将SUMO激活并传递给结合酶E2,最后在连接酶E3的催化下SUMO被结合在目的蛋白上[29]。目前研究显示E1是SAE1(SUMO activating enzyme)和SAE2组成的异构二聚体;E2是蛋白Ubc9;E3对整个酶促反应是非必需的,但却可以大幅提高E2的酶促反应速度,至今发现的有E3活性的的蛋白包括RanBP2、polycomb 2、PIAS家族、TOPORS、TRAF7、线粒体锚定蛋白连接酶(MAPL)和RHES等[29]。
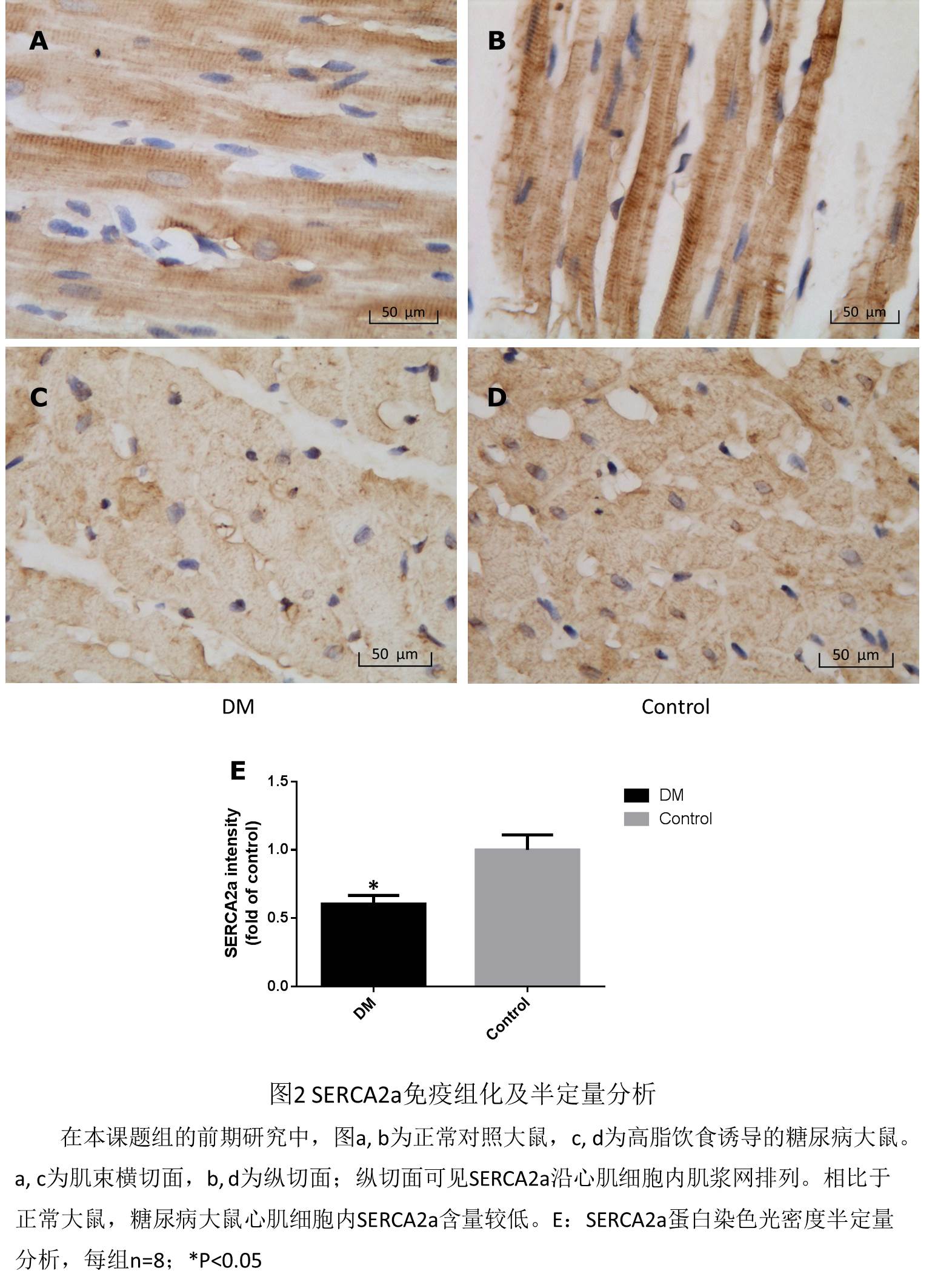
2.4. 糖尿病葡萄糖代谢失衡与小泛素样修饰关系密切
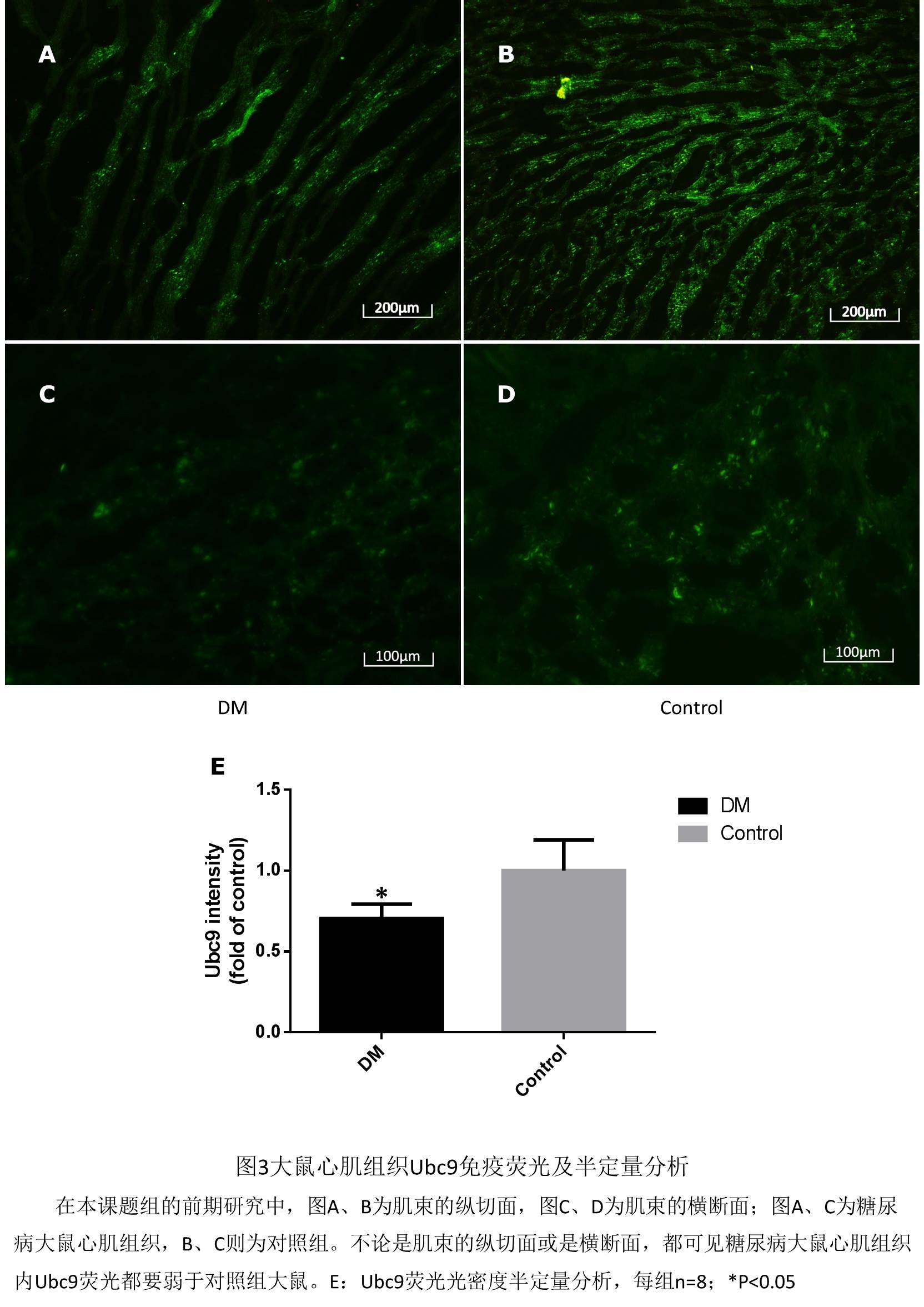
糖尿病可引起心肌细胞内SERCA2a的活性和表达下降[19](见图2所示),推测可能的原因可能有脂代谢异常,自由基损伤和ATP供应减少[20, 21],但这些机制不足以完全解释SERCA2a下降的原因,那么,新近发现的SERCA2a调控方式——“小泛素样修饰”有没有可能是糖尿病状态下,SERCA2a下降的机制之一呢?葡萄糖转运体4(glucose transporter 4, GLUT4)大量存在于骨骼肌和心肌细胞中,与糖脂代谢平衡关系密切,对细胞葡萄糖代谢至关重要[30, 31]。早在2000年PNAS杂志的一篇研究就显示,小泛素样修饰的结合酶E2(Ubc9)与转运体GLUT4密切相关,通过高表达Ubc9,可以使骨骼肌细胞GLUT4上升8倍[32]。2007年Diabetes杂志的一篇研究也显示Ubc9可调节脂肪细胞中的GLUT4的含量[33]。新近的一篇研究显示:在有严重胰岛素抵抗的糖尿病患者骨骼肌细胞中,小泛素样修饰的结合酶E2(Ubc9)和GLUT4表达均下降[34]。此外,我们课题组的前期研究显示,相比于正常大鼠,糖尿病大鼠心肌组织内小泛素样修饰的结合酶E2即Ubc9的蛋白水平下降(见图3所示)。这些均提示糖尿病葡萄糖代谢失衡与小泛素样修饰密切相关。
2.5. 假说的提出
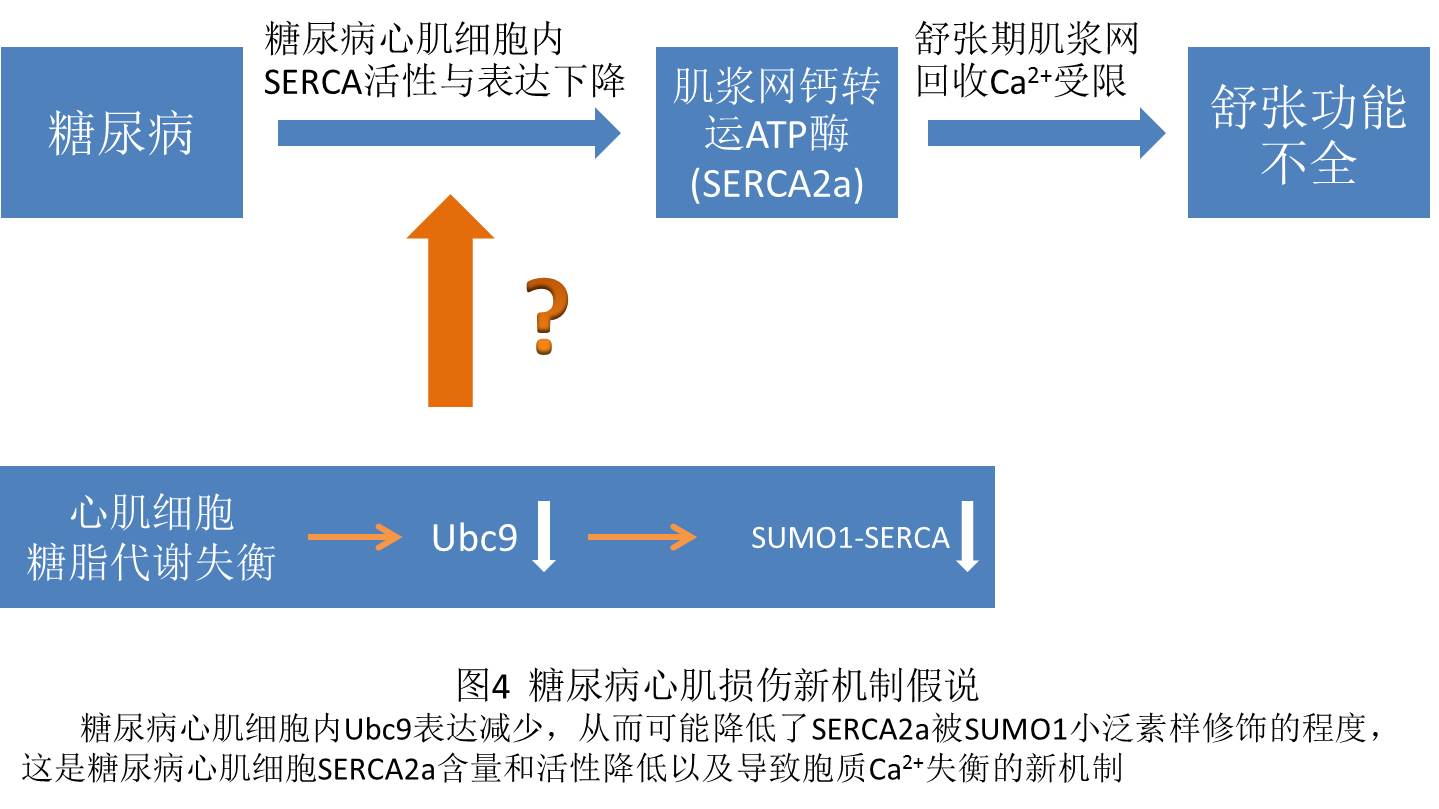
糖尿病对心肌的直接损伤以舒张功能受损为显著表现;SERCA2a是维持心肌细胞胞质Ca2+浓度和舒缩功能的重要蛋白,它的活性和表达下降是糖尿病引起心肌舒张功能不全的重要机制;最新的研究发现了小泛素样修饰可以提高SERCA2a蛋白水平和活性,同时,国内外研究和本课题组的前期工作均提示糖尿病葡萄糖代谢失衡和小泛素样修饰密切相关。综上,我们有理由推测出糖尿病引起心肌组织舒张功能不全的新机制:由于胰岛素抵抗,糖尿病心肌细胞内Ubc9表达减少,从而降低了SERCA2a被SUMO1小泛素样修饰的程度,从而使SERCA2a含量与活性下降。(见图4所示)
参考文献
[1] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China. The New England journal of medicine. 2010; 362(12): 1090-101.
[2] 陈兴宝, 唐玲, 陈慧云, et al. 2型糖尿病并发症对患者治疗费用的影响评估. 中国糖尿病杂志. 2003; 11(4): 238-41.
[3] Boudina S, Abel ED. Diabetic cardiomyopathy revisited. Circulation. 2007; 115(25): 3213-23.
[4] Aurigemma GP. Diastolic heart failure--a common and lethal condition by any name. The New England journal of medicine. 2006; 355(3): 308-10.
[5] Lind L, Andersson PE, Andren B, et al. Left ventricular hypertrophy in hypertension is associated with the insulin resistance metabolic syndrome. Journal of hypertension. 1995; 13(4): 433-8.
[6] Miyazato J, Horio T, Takishita S, et al. Fasting plasma glucose is an independent determinant of left ventricular diastolic dysfunction in nondiabetic patients with treated essential hypertension. Hypertension research : official journal of the Japanese Society of Hypertension. 2002; 25(3): 403-9.
[7] Zeybek C, Aktuglu-Zeybek C, Onal H, et al. Right ventricular subclinical diastolic dysfunction in obese children: the effect of weight reduction with a low-carbohydrate diet. Pediatric cardiology. 2009; 30(7): 946-53.
[8] Stanley WC, Recchia FA, Lopaschuk GD. Myocardial substrate metabolism in the normal and failing heart. Physiological reviews. 2005; 85(3): 1093-129.
[9] Kusuoka H, Marban E. Mechanism of the diastolic dysfunction induced by glycolytic inhibition. Does adenosine triphosphate derived from glycolysis play a favored role in cellular Ca2+ homeostasis in ferret myocardium? The Journal of clinical investigation. 1994; 93(3): 1216-23.
[10] Rijzewijk LJ, van der Meer RW, Smit JW, et al. Myocardial steatosis is an independent predictor of diastolic dysfunction in type 2 diabetes mellitus. Journal of the American College of Cardiology. 2008; 52(22): 1793-9.
[11] Boudina S, Abel ED. Mitochondrial uncoupling: a key contributor to reduced cardiac efficiency in diabetes. Physiology (Bethesda). 2006; 21: 250-8.
[12] Chaitman BR, Pepine CJ, Parker JO, et al. Effects of ranolazine with atenolol, amlodipine, or diltiazem on exercise tolerance and angina frequency in patients with severe chronic angina: a randomized controlled trial. JAMA : the journal of the American Medical Association. 2004; 291(3): 309-16.
[13] 宋光远. 糖尿病心肌病存在和机制. 心血管病学进展. 2011; 32(4).
[14] Choi KM, Zhong Y, Hoit BD, et al. Defective intracellular Ca(2+) signaling contributes to cardiomyopathy in Type 1 diabetic rats. American journal of physiology Heart and circulatory physiology. 2002; 283(4): H1398-408.
[15] Song GY, Yang YJ, Xu B, et al. ST-elevated acute myocardial infarction happening 1 month post stent implantation: late thrombosis in-stents or new lesions? Chinese medical journal. 2009; 122(14): 1610-4.
[16] 裴汉军, 吴永健, 惠汝太, et al. 阿托伐他汀干预对糖尿病心肌梗死后大鼠左室重构和心功能的影响. 中国分子心脏病学杂志. 2010; 10(1): 6.
[17] 宋光远, 王喜梅, 杨跃进, et al. STZ诱导的糖尿病大鼠急性心肌梗死后心脏重构及相关基因的表达. 中国病理生理杂志. 2009; 25(12): 8.
[18] Kim HW, Ch YS, Lee HR, et al. Diabetic alterations in cardiac sarcoplasmic reticulum Ca2+-ATPase and phospholamban protein expression. Life sciences. 2001; 70(4): 367-79.
[19] Trost SU, Belke DD, Bluhm WF, et al. Overexpression of the sarcoplasmic reticulum Ca(2+)-ATPase improves myocardial contractility in diabetic cardiomyopathy. Diabetes. 2002; 51(4): 1166-71.
[20] Dhalla NS, Liu X, Panagia V, et al. Subcellular remodeling and heart dysfunction in chronic diabetes. Cardiovascular research. 1998; 40(2): 239-47.
[21] Han X, Abendschein DR, Kelley JG, et al. Diabetes-induced changes in specific lipid molecular species in rat myocardium. The Biochemical journal. 2000; 352 Pt 1: 79-89.
[22] Kranias EG, Hajjar RJ. Modulation of cardiac contractility by the phospholamban/SERCA2a regulatome. Circ Res. 2012; 110(12): 1646-60.
[23] Hadri L, Bobe R, Kawase Y, et al. SERCA2a gene transfer enhances eNOS expression and activity in endothelial cells. Molecular therapy : the journal of the American Society of Gene Therapy. 2010; 18(7): 1284-92.
[24] Lipskaia L, Chemaly ER, Hadri L, et al. Sarcoplasmic reticulum Ca(2+) ATPase as a therapeutic target for heart failure. Expert opinion on biological therapy. 2010; 10(1): 29-41.
[25] Prunier F, Kawase Y, Gianni D, et al. Prevention of ventricular arrhythmias with sarcoplasmic reticulum Ca2+ ATPase pump overexpression in a porcine model of ischemia reperfusion. Circulation. 2008; 118(6): 614-24.
[26] Lyon AR, Bannister ML, Collins T, et al. SERCA2a gene transfer decreases sarcoplasmic reticulum calcium leak and reduces ventricular arrhythmias in a model of chronic heart failure. Circulation Arrhythmia and electrophysiology. 2011; 4(3): 362-72.
[27] Kho C, Lee A, Jeong D, et al. SUMO1-dependent modulation of SERCA2a in heart failure. Nature. 2011; 477(7366): 601-5.
[28] Mahajan R, Delphin C, Guan T, et al. A small ubiquitin-related polypeptide involved in targeting RanGAP1 to nuclear pore complex protein RanBP2. Cell. 1997; 88(1): 97-107.
[29] Wang J. Cardiac function and disease: emerging role of small ubiquitin-related modifier. Wiley interdisciplinary reviews Systems biology and medicine. 2011; 3(4): 446-57.
[30] Bryant NJ, Govers R, James DE. Regulated transport of the glucose transporter GLUT4. Nature reviews Molecular cell biology. 2002; 3(4): 267-77.
[31] Steinbusch LK, Schwenk RW, Ouwens DM, et al. Subcellular trafficking of the substrate transporters GLUT4 and CD36 in cardiomyocytes. Cellular and molecular life sciences : CMLS. 2011; 68(15): 2525-38.
[32] Giorgino F, de Robertis O, Laviola L, et al. The sentrin-conjugating enzyme mUbc9 interacts with GLUT4 and GLUT1 glucose transporters and regulates transporter levels in skeletal muscle cells. Proc Natl Acad Sci U S A. 2000; 97(3): 1125-30.
[33] Liu LB, Omata W, Kojima I, et al. The SUMO conjugating enzyme Ubc9 is a regulator of GLUT4 turnover and targeting to the insulin-responsive storage compartment in 3T3-L1 adipocytes. Diabetes. 2007; 56(8): 1977-85.
[34] Kampmann U, Christensen B, Nielsen TS, et al. GLUT4 and UBC9 protein expression is reduced in muscle from type 2 diabetic patients with severe insulin resistance. PloS one. 2011; 6(11): e27854.
研究内容及研究方案
1.研究目标、研究内容和拟解决的关键问题
1.1 研究目标:
一、 证实糖尿病通过降低心肌细胞内Ubc9-SERCA2a小泛素样修饰这一途径损伤心肌舒缩功能;
二、 通过使用曲美他嗪,探索能量代谢干预是否能通过Ubc9-SERCA2a小泛素样修饰这一途径改善心肌舒缩功能。
1.2 研究内容:
一、 从整体动物水平上证实在2型糖尿病状态下,心肌细胞SERCA2a小泛素样修饰程度以及Ubc9等小泛素样修饰关键酶的蛋白表达下降,并明确通过曲美他嗪改善能量代谢失衡在整体水平上是否有增强心肌细胞SERCA2a小泛素样修饰和升高Ubc9等相关蛋白的作用:
1. 建立2型糖尿病大鼠模型及普通对照组大鼠,两组大鼠均分别再分为两组,曲美他嗪干预组和不干预组。
2. 通过超声心动图和左室压力测定比较各组大鼠心脏收缩舒张功能。
3. 取大鼠心肌组织,通过病理切片比较各组大鼠心脏形态变化,通过免疫组化和免疫荧光比较各组大鼠心肌细胞内Ubc9以及SUMO1和SERCA2a的表达情况。
4. 用免疫共沉淀和Western Blot的方法分析与SUMO1结合的SERCA2a的蛋白质水平;用Western Blot和RT-PCR测定小泛素样修饰关键酶SENP1、SAE、Ubc9以及SUMO1和SERCA2a的表达情况。
(注:“研究内容一”部分内容已在本课题组的前期实验中完成,相关结果可见立题依据)
二、通过尾静脉注射腺相关病毒,在大鼠心肌细胞内过表达Ubc9,进一步证明糖尿病通过降低心肌细胞内Ubc9-SERCA2a小泛素样修饰这一途径损伤心肌舒张功能:
1.建立2型糖尿病大鼠模型及普通对照组大鼠,两组大鼠均分别再分为两组,Ubc9腺相关病毒干预组和不干预组。
2. 取大鼠心肌组织提取总RNA,反转录成cDNA文库并扩增Ubc9等小泛素样修饰关键酶的序列,包装构建含MHC启动子序列和Ubc9序列的腺相关病毒;通过尾静脉注射,将病毒导入干预组大鼠体内
3. 通过超声心动图和左室压力测定比较各组大鼠心脏收缩舒张功能,以证明心肌细胞内过表达Ubc9可以改善糖尿病大鼠的舒缩功能。
4. 取大鼠心肌组织,用免疫共沉淀和Western Blot的方法测定与SUMO1结合的SERCA2a的蛋白质水平;用Western Blot和RT-PCR测定小泛素样修饰关键酶SENP1、SAE、Ubc9以及SUMO1和SERCA2a的表达情况,以证明过表达Ubc9改善SERCA2a小泛素样修饰,增加了SERCA2a的蛋白水平。
三、通过原代培养乳鼠心肌细胞,在细胞水平上探索高脂肪酸和曲美他嗪干预对心肌细胞内Ubc9-SERCA2a小泛素样修饰途径的作用
1. 选取乳大鼠分离心肌,获取原代心肌细胞并培养。
2. 设立对照组并使用高脂肪酸,曲美他嗪以及高脂肪酸+曲美他嗪分别刺激心肌细胞。
3. 通过激光共聚焦显微镜和免疫荧光比较各组细胞内Ubc9以及SUMO1和SERCA2a等相关蛋白的表达情况。
4.用免疫共沉淀和Western Blot的方法测定与SUMO1结合的SERCA2a的蛋白质水平;用Western Blot和RT-PCR测定小泛素样修饰关键酶SENP1、SAE、Ubc9以及SUMO1和SERCA2a的表达情况。以明确高脂肪酸或曲美他嗪对心肌细胞内Ubc9-SERCA2a小泛素修饰途径有下调或上调的作用。
四、 通过含Ubc9 shRNA的慢病毒转染原代心肌细胞,抑制Ubc9在心肌细胞中的表达,在细胞水平上进一步明确高脂肪酸和曲美他嗪干预是否通过Ubc9作用于SERCA2a的小泛素样修饰:
1. 选取乳大鼠分离心肌,获取原代心肌细胞并培养。
2. 选择成品的含Ubc9 shRNA的慢病毒分别转染至培养的原代心肌细胞中,设立对照组并使用高脂肪酸,曲美他嗪以及高脂肪酸+曲美他嗪分别刺激各组心肌细胞。
3. 通过激光共聚焦显微镜和免疫荧光比较各组细胞内Ubc9以及SUMO1和SERCA2a等相关蛋白的表达情况。
4. 用免疫共沉淀和Western Blot的方法测定与SUMO1结合的SERCA2a的蛋白质水平;用Western Blot和RT-PCR测定小泛素样修饰关键酶SENP1、SAE、Ubc9以及SUMO1和SERCA2a的表达情况。
1.3 拟解决的关键问题:
一、证实糖尿病通过降低心肌细胞内Ubc9-SERCA2a小泛素样修饰这一途径损伤心肌舒张功能:
1. 通过研究内容一,初步证实糖尿病大鼠心肌细胞中存在Ubc9表达减少和SERCA2a小泛素样修饰下降,以及心脏舒缩功能下降的现象。
2. 通过研究内容二,在糖尿病大鼠心肌细胞内过表达Ubc9,通过分子生物学实验观察SERCA2a小泛素样修饰水平是否得到改善,通过超声和心室测压比较糖尿病大鼠心肌舒缩功能是否得到恢复,从而进一步证明糖尿病大鼠心肌舒缩功能下降与心肌细胞内Ubc9-SERCA2a小泛素样修饰这一途径下降是密切相关的。
二、探索并阐明高脂肪酸和曲美他嗪干预在是否通过心肌细胞Ubc9等小泛素样修饰系统调节SERCA2a。
1.通过研究内容一,从整体动物水平探索曲美他嗪对大鼠心肌细胞Ubc9-SERCA2a小泛素样修饰这一途径的影响;通过研究内容三,从细胞水平上分别探索曲美他嗪和/或高脂肪酸对心肌细胞Ubc9-SERCA2a小泛素样修饰这一途径的影响。
2.通过研究内容四,抑制心肌细胞内Ubc9的表达,观察曲美他嗪和/或高脂肪酸对SERCA2a的调节作用,进一步明确曲美他嗪和高脂肪酸通过Ubc9等小泛素修饰系统调节SERCA2a。
2.拟采取的研究方法、技术路线、实验方案及可行性分析、统计学方法
2.1拟采取的研究方法
2型糖尿病模型大鼠建立:
1. 使用1.5%胆固醇、0.25%胆酸钠、10%猪油、5%蔗糖、83.25%基础饲料的配方交予大鼠饲料公司生产高脂高糖饲料。
2. 使用高脂高糖饲料喂养大鼠12周诱导产生胰岛素抵抗和糖尿病,普通饲料喂养对照组大鼠12周。
3. 禁食4小时后,剪尾滴血测定血葡萄糖含量,>7.0mmol/L的大鼠确定为模型构建成功。
大鼠超声心动图检查:
大鼠腹腔注射10%水合氯醛麻醉后,剔除胸腹部毛发,仰面固定于带有肢导心电图的小动物超声平台上,取大鼠心脏短,长轴及四腔心切面,并于短轴切面取M型超声,四腔切面使用心肌多普勒技术测定二尖瓣舒张期运动速率;获得心率(HR)、左室收缩期内径(LVIDd)、左室舒张期内径(LVIDs)、缩短分数(FS)、射血分数(EF)、二尖瓣舒张早晚期速率比(E’/A’)等指标。
大鼠左室压力测定及心脏取材:
1. 大鼠腹腔注射10%水合氯醛麻醉后,固定、剪毛, 颈前正中作纵行皮肤切口(长约2 cm) , 用止血钳钝性分离筋膜、肌间隙, 游离出右侧颈总动脉后结扎其远心端,将已用液体石蜡润滑的导管从切口处插入颈总动脉,结扎线稍做固定,撤去动脉夹,此时观察显示器上的波形为动脉血压波形,然后顺应血管走行方向缓缓推入插管,动脉血压波形突然转变为振幅和波宽高大的左心室内压波形,舒张压为零附近时,提示插管已达左心室内。与心电、股动脉压同步记录, 系统可以自动分析出收缩期末心室压、舒张期末心室压、dp/dt、-dp/td等血流动力学指标。
2. 撤去多导生理仪接头,沿颈动脉插管注入15-20mlPBS液灌流心脏,剪开胸腔,取下心脏置于冰上,在冰上快速减去多余组织,分离左右室,并置于液氮中保存,病理切片用心脏置于多聚甲醛中固定。
免疫组织化学染色
1. 烤片:68℃,20 min。
2. 常规二甲苯脱蜡,梯度酒精脱水:二甲苯I 20 min?二甲苯II 20 min?00%酒精10 min?100%酒精10 min?95%酒精5 min?80%酒精5 min?70%酒精5 min。
3. 阻断灭活内源性过氧化物酶:3%H2O2 37℃孵育10 min,PBS冲洗3X5 min。
4. 抗原修复:置0.01 M枸橼酸缓冲液(PH6.0)中用煮沸(95℃,15-20 min),自然冷却20 min以上,再用冷水冲洗缸子,加快冷却至室温,PBS冲洗3X5 min。
5. 正常羊血清工作液封闭,37℃10 min,倾去勿洗。
6. 滴加一抗4℃冰箱孵育过夜,PBS冲洗3X5 min(用PBS缓冲液代替一抗作阴性对照);滴加生物素标记二抗,37℃孵育30 min,PBS冲洗3X5 min。
7. 滴加辣根过氧化物酶标记的链霉素卵白素工作液,37℃孵育30 min,PBS冲洗3X5 min。
8. DAB/H2O2反应染色,自来水充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。
原代心肌细胞培养
1. 选取出生48 小时以内的乳大鼠,用75%酒精消毒后,剪开胸腔,钝性分离心脏,预冷PBS缓冲液,反复清洗3次,剪成3 mm3大小的块状,放入小瓶子中。
2. 加入0.25%胰蛋白酶,4 ℃放置16 h。然后小心去除胰酶,重新加入0.25%胰酶,37 ℃放置20 min,加入含10%新生牛血清的DMEM培养基终止消化后,用吸管轻轻吹打混合物至组织完全散开。
3. 100目钢筛过滤细胞悬液,滤液收集于10 mL刻度离心管中。然后按差速贴壁分离法将细胞置于培养箱孵育2 h,纯化心肌细胞。
4. 未贴壁细胞计数后,加入终浓度为0.1 mmol/L的5’-溴-2’-脱氧尿苷,抑制非心肌细胞成长,按1×106/mL的细胞浓度接种于24孔板,每孔1 mL。置37 ℃、5%CO2细胞培养箱中培养。每24 h更换1次培养液,培养3~5 d待实验。
基因扩增及腺病毒包装、纯化及感染:
1. 挑选2~3个月龄,重150~200g的健康SD雌性大鼠。用10%水合氯醛腹腔注射麻醉,在左胸第4~5肋骨间作横切口打开胸腔,取出心脏。用Trizol法提取总RNA,溶于适量RNase-free水中,-70℃保存备用。取1-2μg总RNA,按照逆转录试剂盒提供的方法(GIBCOBRL公司),应用锚定引物将其反转录成大鼠心脏cDNA文库。
2. 用目的基因特异引物扩增Ubc9等基因编码序列,经过胶回收纯化后分别将目的DNA片段和pAdEasy克隆载体连接。转化至E.coli感受态JM109中,选取阳性菌落提取质粒后测序鉴定。确定获得阳性克隆后,再挑取阳性菌落,悬浮培养6-10小时后,再加入等体积的60%甘油,充分混匀后,分装到1.5ml离心管内,-70℃储存。
3. 重组pAdEasy质粒的线性化:取重组腺病毒质粒8g,用PacI酶切(1U/1μg DNA),3h完全消化以切去原穿梭质粒携带的ori和kan抗性基因等质粒元件,并暴露其反转末端重复序列。酶切产物经酚/氯仿抽提,乙醇沉淀,溶于无菌水中。
4. 转染293细胞及初次扩增:存储病毒转染后7-10天吹下细胞,并将细胞转移到50ml离心管内,离心后将细胞团块溶于2ml 10%DMEM中,于-70℃/37℃进行4轮彻底冻/融/剧烈振荡,短暂离心,将上清存于-70℃。用上述收集的每一瓶病毒上清的30-50%去感染2瓶T-25cm2培养瓶的293细胞(70-80%融合),用上述相同的离心和冻融方法收集病毒。
5. 将293 细胞以50-70%的汇合率铺于60 mm 培养盘中,以30-50%的体积比加入含病毒上清液。感染后3-5 天收集病毒。可进一步通过Western blot 或PCR证实重组腺病毒的存在;
6. 收集病毒上清,进一步感染100 mm 培养盘的细胞,收集病毒,并进而将其感染150 mm 细胞培养盘中的293细胞,以获得足够量的病毒;将最终富集病毒颗粒的病毒上清滴加于CsCl梯度溶液上;超速离心,30000g,4 度离心16 个小时;离心后,收集位置较低,颜色较亮的条带含有活病毒颗粒。在TBS 中透析一小时,随后在含有10%甘油的TBS 中透析两次,每次一小时。将纯化的腺病毒分装于EP 管中;于-70 度中保存。
7. 感染心肌细胞的最适病毒浓度选择:将1x105细胞/cm2的心肌细胞接种到96孔板内,每个孔内加入不同稀释度的上述病毒颗粒(101、102、103、104、105、106)的病毒,培养10天后,显微镜观察细胞的生长状况和绿色荧光蛋白的数量,选择合适的病毒浓度感染心肌细胞。
免疫共沉淀与Western Blot:
1. 细胞转染后24-36 小时后,吸净培养液。加入500μl预冷的1×lysis buffer, 于4℃或冰上放置裂解细胞5 分钟。将细胞裂解液转移到1.5 ml eppondorf管内,于冷冻离心机4℃,13000 g离心30分钟。
2. 将离心后的上清液分为两份:一份35μl,加入等体积的2×SDS sample buffer, 混匀后于100℃煮10 分钟,做为总细胞裂解液(total cell lysate,TCL)于-20℃保存,或取6-10 μl 进行SDS-PAGE 电泳,Western blot 检测目的蛋白的表达水平(接第5 步)。另一份用于免疫沉淀,具体操作如下:
1)分A/G beads:按每管(一个免疫沉淀样品)加入5 μl Agrose A/G beads及5 μl(1 μg)抗体计算一次实验所用beads 及抗体的总量,将抗体和beads 混合,补充lysis buffer (补充的lysis buffer 的量能使每管能均匀分配到50 μl beads及抗体的混合物),将beads 及抗体的混合物按每管50 μ(l 含5 μl beads 及5 μl 抗体)分配到1.5 ml Eppendorf管中,再加入400 μl 1×lysis buffer,备用;
2)从步骤2中另一份用于免疫沉淀的上清液中取400 μl加入到上一步(步骤1))已分好的beads 中,使终体积达到850 μl,将管子固定到混匀器上使混匀器匀速旋转(15 rpm)免疫沉淀3 小时;
3)将免疫沉淀后的溶液于4℃ 3000 g离心3 分钟,去上清,加入500μl1×lysis buffer 洗涤beads,于冷冻离心机4℃ 3000 g离心3 分钟,弃上清,共洗涤三次。
4)最后一次洗涤完毕,弃上清,管中只剩Beads,加入35 μl 1×lysis buffer 与等体积2×SDS sample buffer 混合,于100℃煮沸10 分钟,稍离心后取10μl 左右样到PAGE 胶,进行电泳,或-20℃冻存。
3. 电泳完毕后,取下PAGE 胶,与PVDF 膜做成"三明治"形状,用湿转法进行电转1小时。取下PVDF 膜,加入5%脱脂奶粉,于脱色摇床摇荡(75 rpm)封闭1 小时以消除非特异背景。封闭完毕,用TBST 洗掉牛奶,加入一抗,于脱色摇床摇荡孵育(75 rpm)1小时,使一抗与特异蛋白结合。
4. 回收一抗,用TBST 洗3 次(75 rpm),每次5-10 分钟。加入二抗,于脱色摇床孵育1 小时,使二抗与一抗结合。用TBST 洗3 次,每次5-10 分钟。
5. 将ECL A 液和ECLB 液各1ml,混匀,放入二抗孵育后的PVDF 膜30 秒,将PVDF 膜平铺于曝光盒中,进暗房,用医学X光胶片曝光。经过显影、定影后的胶片,于室温下自然风干或烘干,描画蛋白marker 便于分析。
RT-PCR:
1. 用Trizol法提取总RNA,溶于适量RNase-free水中。
2. 引物合成:在NCBI上搜索目的基因并设计其引物,内参照:GAPDH(452bp) 正义:5-ACCACAGTCCATGCCATCAC-3,反义:5-TCCACCACCCTGTTGCTGTA-3;
3. 逆转录反应:RNA 23μl(11.5μl) ;Oligo(dT)15 0.05μg/μl 4μl(2μl) 0.005μg/μl (稀释10倍后用)混匀,离心,70℃ 5min 立即冰水浴,稍离心,混匀,离心,42℃ 60min ,95℃ 10min(破坏MLV) 4℃保存
4. PCR反应:经过95℃ 5分预变性;94℃ 30秒变性;X℃ 40秒退火;72℃ 30秒延伸;72℃ 7分终末延伸;28-36循环后置于4℃中保存
5. 电泳:加已点在纸上的6×上样缓冲液,反复吸打混匀后进行电泳,一般用稳压状态进行电泳,100V左右,电泳20-30分钟,紫外灯下观察,结果进行扫描保存。
2.2技术路线及实验方案
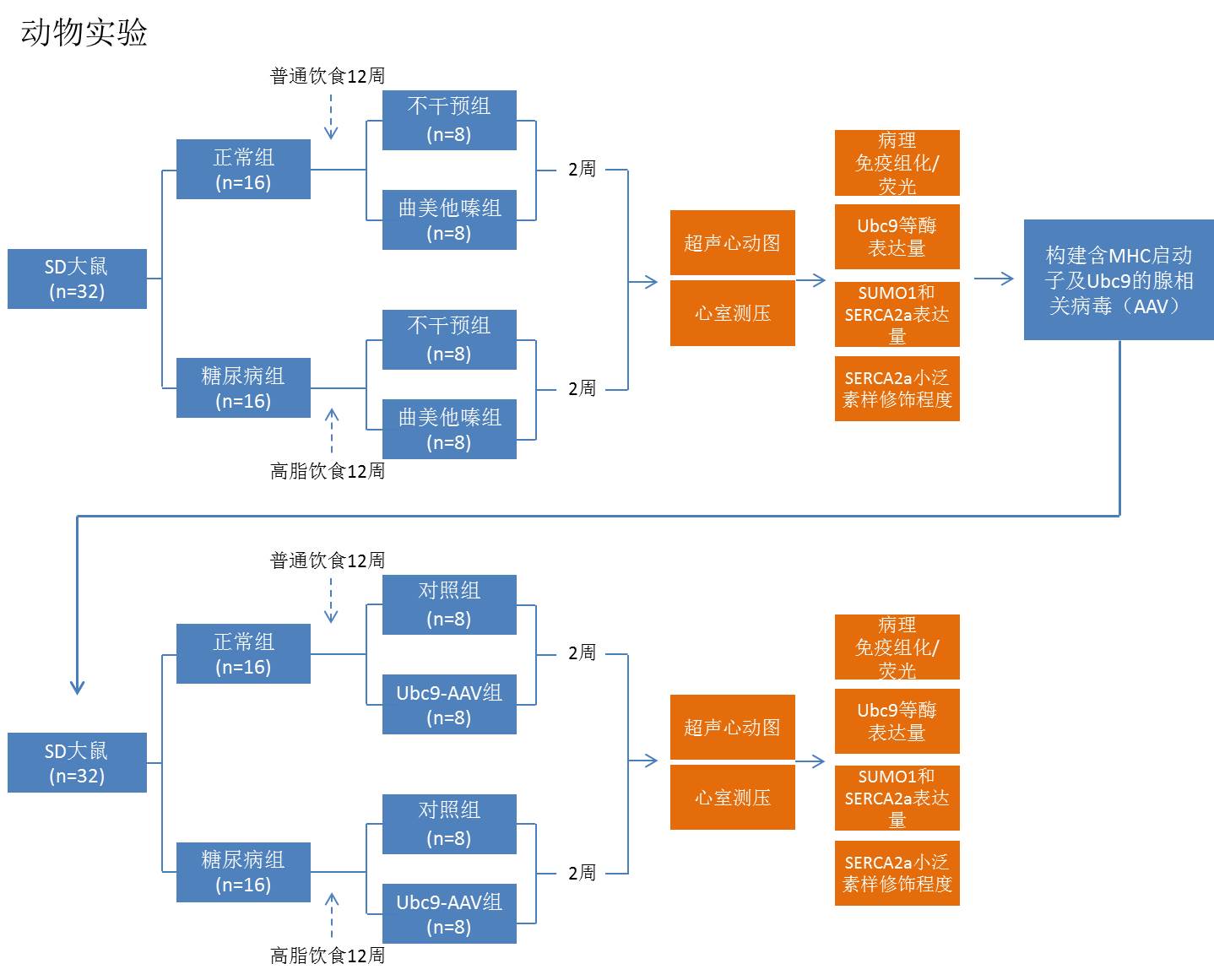
动物实验:
[1] 通过高脂饮食诱导12周建立2型糖尿病大鼠模型及普通对照组大鼠,两组大鼠均分别再分为两组,曲美他嗪干预组和不干预组。
[2] 通过超声心动图和左室压力测定评估大鼠心脏收缩舒张功能。
[3] 取大鼠心肌组织,通过病理切片比较各组大鼠心脏形态变化,通过免疫组化和免疫荧光比较各组大鼠心肌细胞内Ubc9以及SUMO1和SERCA2a的表达情况。
[4] 取大鼠心肌组织,用免疫共沉淀和Western Blot的方法测定与SUMO1结合的SERCA2a的蛋白质水平;用Western Blot和RT-PCR测定小泛素样修饰关键酶SENP1、SAE、Ubc9以及SUMO1和SERCA2a的表达情况。
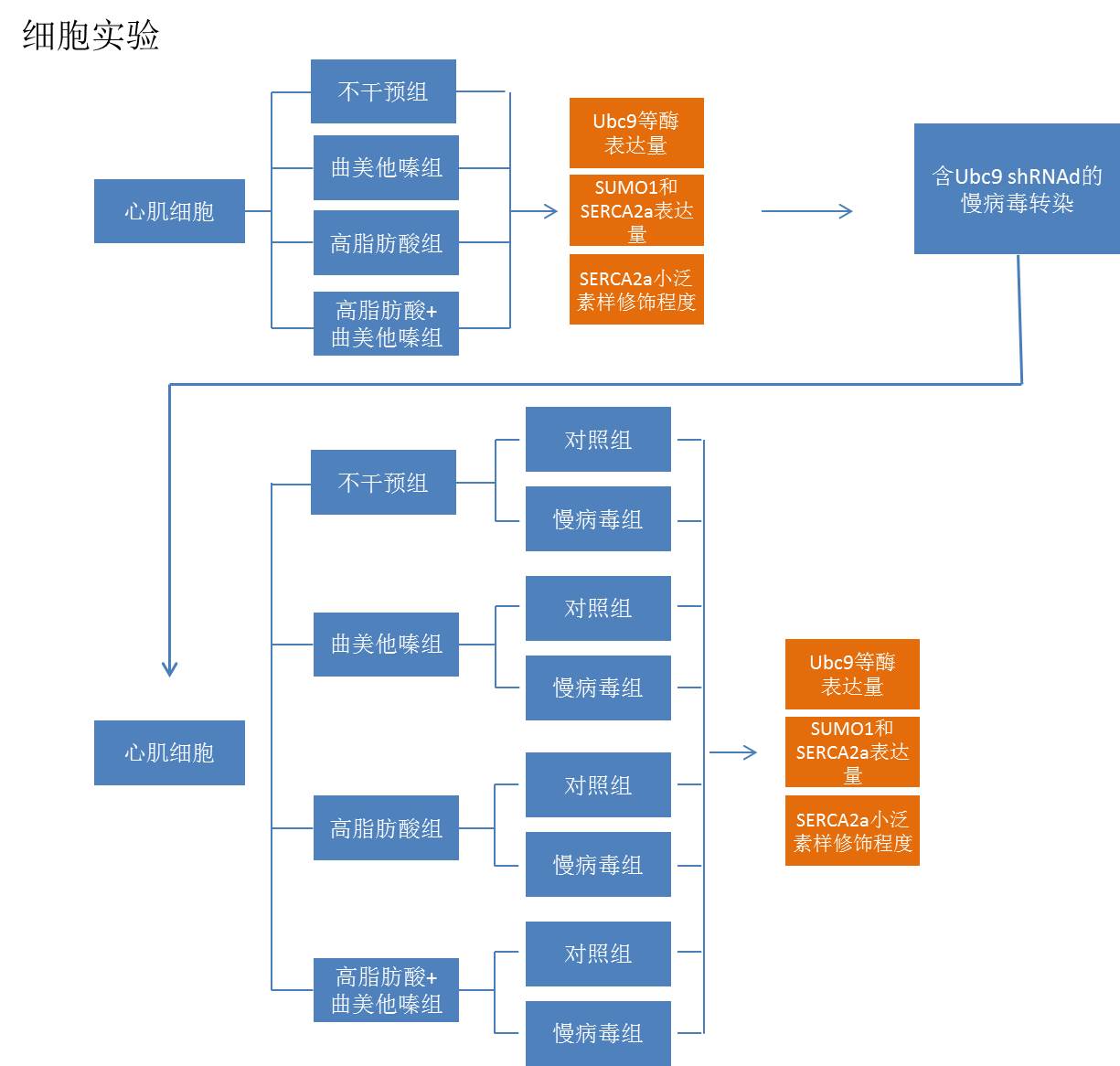
细胞实验:
1. 选取乳大鼠分离心肌,获取原代心肌细胞并培养。
2. 设立对照组并使用高脂肪酸,曲美他嗪以及高脂肪酸+曲美他嗪分别培养心肌细胞。
3. 使用激光共聚焦显微镜和免疫荧光分析各组细胞Ubc9以及SUMO1和SERCA2a的蛋白水平。
4. 用免疫共沉淀和Western Blot的方法测定与SUMO1结合的SERCA2a的蛋白质水平;用Western Blot和RT-PCR测定小泛素样修饰关键酶SENP1、SAE、Ubc9以及SUMO1和SERCA2a的表达情况。
可行性分析
1.立题依据充分,并有预试验结果支持
本项目成员均一直从事于心血管疾病和糖尿病诊治和科研工作,在既往的研究基础上,紧随国内外研究的新动态和热点,根据国内外现有的研究成果,率先提出了糖尿病通过Ubc9-SERCA2a途径的心肌损伤新机制,立题有着充分的合理性,此外还有本课题组的预试验结果支持,我们的预试验结果显示:(1)高脂饮食诱导的糖尿病大鼠糖尿病大鼠舒缩功能均下降,尤以舒张功能(-dp/dt; E’/A’)更为明显;(2)相比于正常大鼠,糖尿病大鼠心肌细胞内SERCA2a蛋白水平较低;(3)相比于正常大鼠,糖尿病大鼠心肌细胞内Ubc9蛋白水平较低。(具体结果可见前文立题依据所示)以上结果强烈的提示本项目假说的合理性,并预示着较好的结果。
2. 合理的项目成员组成
本项目有3名高级研究人员参加,分别是多年以来从事心血管,心血管基础和糖尿病研究的中青年科研骨干,有着丰富的临床经验和科研经验,研究领域与本项目均密切相关,具有夯实的研究基础。2名中级技术人员分别具有多年的分子生物学实验和动物实验经验。2名初级技术人员和1名在读硕士研究生均为活跃在科研第一线、受到了良好的科研训练、朝气蓬勃的年轻人。本项目成员结构合理,实验所需相关人员齐全,是本项目能够顺利实施的强大保障。
3.海军总医院及阜外心血管病医院完备的工作条件
项目申报者所在的单位为中国人民解放军海军总医院,另有部分项目组成员来自中国医学科学院阜外心血管病医院。海军总医院科研条件完备,设有生化室、细胞培养室、分子生物学室。拥有大量科研仪器设备,特别是拥有比较完善的科研平台。阜外心血管病医院作为国家心脏病中心、有国家心血管病重点实验室作为依托,是我国心血管疾病科研实力最为雄厚,平台最为齐全,拥有完备的大型仪器和各项实验条件以及丰富的科研团队和技术专家。
2.4统计学分析
所有连续性变量均由均数+标准误( +se)表示,两组间比较的统计学分析使用独立样本t检验,所有计数资料比较采用χ2检验,,必要时应用Fisher精确概率法,使用SPSS19软件进行统计学分析。
+se)表示,两组间比较的统计学分析使用独立样本t检验,所有计数资料比较采用χ2检验,,必要时应用Fisher精确概率法,使用SPSS19软件进行统计学分析。
3. 研究计划及预期研究成果
3.1 研究计划
2015年1月~2015年12月:
1.
2型糖尿病动物模型建立、曲美他嗪干预、超声心动图检测、左室压力测定等动物实验;
2.
完成免疫共沉淀和Western Blot的方法测定2型糖尿病大鼠心肌细胞内SERCA2a小泛素样修饰程度;
3.
完成大鼠心肌细胞内Western Blot和RT-PCR检测小泛素样修饰关键酶以及SUMO1和SERCA2a等蛋白表达等实验。
2016年1月~2016年12月
1.
原代心肌细胞培养,分组;高脂肪酸及曲美他嗪干预培养心肌细胞;
2.
免疫共沉淀和Western Blot的方法测定培养的心肌细胞内SERCA2a小泛素样修饰程度;
3.
Western
Blot和RT-PCR测定心肌细胞内小泛素样修饰关键酶SENP1、SAE、Ubc9以及SUMO1和SERCA2a的表达情况。
4. 大鼠心肌细胞RNA抽提和Ubc9等小泛素样修饰关键酶的基因扩增;
5. 带有Ubc9等小泛素样修饰关键酶的大鼠基因质粒的腺病毒的包装、纯化和感染等工作;
2017年1月~2017年12月
1.
腺病毒转染后的免疫共沉淀和Western Blot的方法测定培养的心肌细胞内SERCA2a小泛素样修饰程度;Western Blot和RT-PCR测定小泛素样修饰关键酶以及SUMO1和SERCA2a等蛋白表达。
2.
数据整理及统计学分析
3.
论文撰写及发表
4.
参加学术会议
3.2 预计研究成果
2-3篇SCI文章,中文核心期刊文章2-3篇
四、研究基础
1. 研究团队基础
申请人姚晶,男,28岁。于2003年就读于华中科技大学同济医学院临床医学六年制德语班,2008年被推荐至德国海德堡大学内科医院实习两个月。2009年本科毕业被协和医学院阜外心血管病医院录取为硕士研究生,硕博连读;师从我国著名心脏病学专家吴永健教授。硕士期间不仅参与临床实习,能够熟练应对心内科常见疾病,更加深入学习文献检索,医学统计,分子生物学及动物实验技术,可以独立熟练的完成大鼠心梗模型,心室测压,取材等动物实验,以及原代心肌细胞培养、Western Blot、PCR、免疫荧光等细胞分子生物学实验。博士期间参与课题组多项基金申请,并作为标书撰稿人成功协助课题组取得国自然青年基金1项,教育部博士点基金2项,以及北京协和医学院研究生创新基金1项。申请人研究生期间一直从事于心肌细胞能量代谢的相关研究,目前已发表相关中文综述两篇,论著一篇,英文SCI综述一篇,论著一篇。
本项目有多名海军总医院和阜外心血管病医院的中高级研究人员参加,他们均为活跃在临床和科研一线的年富力强的中青年科研骨干,具有丰富的科研基础和工作经验,是本研究能够顺利完成的重要保证;3名初级科研人员一直从事与科研一线工作,1名硕士研究生从事于糖尿病心肌细胞损伤的研究,可以保证每年充分足够的研究时间,是本研究可以顺利完成的重要基础。
2. 工作条件
项目申报者所在的单位为中国人民解放军海军总医院,另有项目组成员来自中国医学科学院阜外心血管病医院。海军总医院科研条件完备,设有生化室、细胞培养室、分子生物学室。拥有大量科研仪器设备,细胞培养室、显微成像采集处理分析系统、五人共览显微镜、倒置相差显微镜、万能显微镜、扫描电子显微镜、透射电子显微镜和激光共聚焦显微镜、定量PCR扩增仪、普通PCR仪、凝胶成像系统、各种电泳设备、大型超速冷冻离心机、深低温冰箱、CO2培养箱、三气培养箱、液氮储存系统、核酸定量仪、生理多导仪、测序仪器、流式细胞仪以及细胞生物学研究所需相关的研究设备,具备强劲的科研能力及完备的科研条件,具有完成本项目所需的全部实验条件。阜外心血管病医院作为国家心脏病中心、有国家心血管病重点实验室作为依托,是我国心血管疾病科研实力最为雄厚,平台最为齐全,拥有完备的大型仪器和各项实验条件以及丰富的科研团队和技术专家
中国人民解放军海军总医院申请者:姚晶