消化在线: 曲美他嗪在血管成形术后再狭窄中的能量
来源:
一、立题依据
1.研究意义
随着人民生活水平提高,人口老年化趋势的出现,冠状动脉粥样硬化性心脏病(简称冠心病)的发病率逐年上升,特别是在经济发达的大城市比较明显,已成为威胁我国城市人群的主要杀手之一。急性冠脉综合征(Acute Coronary Syndrome,ACS)是冠心病的一种重要形式。与稳定型心绞痛患者比较,ACS患者日后发生冠状动脉事件的危险性将大大增加[1]。Ⅱb/Ⅲa受体干预试验提示约5%-10%的ACS患者在ACS发作后1个月出现非致命性心肌梗死,2%-5%的患者在1个月内死亡[2]。当然,急性心肌梗死的死亡风险仍然是最高的,约50%患者在就诊前死亡[3]。
血管内支架成形术是近年来发展起来的治疗急性冠脉综合征的方法。对于UA/NSTEMI患者,目前认为对于高危患者急诊应该行PCI治疗,中危患者72小时内行冠脉PCI治疗。PCI是目前治疗冠状动脉粥样硬化所致缺血性心脏病的有效方法之一,然而,随着支架在介入治疗中的广泛应用,支架植入和血管成形术后再狭窄(restenosis,RS)已经成为严重影响血管内支架植入术的主要障碍[4]。研究表明,由于手术引起的脂肪斑块破裂、内皮剥脱、肌层损伤等原因,术后3-6个月,有30-60%患者可出现手术局部的再狭窄(restenosis,RS)[5]。起病理特征包括:局部炎症侵润、血小板黏附、血栓形成,血管平滑肌细胞(vascular smooth muscle cell,VSMC)增殖和迁移,内膜增厚,弹性回缩和血管重构,官腔狭窄等[6,7]。目前,相关的机制尚未阐明,防治手段也很有限。由于再狭窄而采取的再次治疗不仅给患者带来新的痛苦和经济、精神负担,而且耗费了大量的医疗资源。因而寻求防治再狭窄的经济、有效的方法和途径成为目前全球医疗研究的焦点[8,9]。
2.国内外研究现状
临床研究证实,经皮腔内冠状动脉成形术( PTCA)的术后血管再狭窄主要包括血栓期、炎症期、增生期、基质沉着、血管重塑期[10]。血管平滑肌细胞(VSMC)的过度增生是导致血管内膜增厚、细胞外基质沉积和血管再狭窄发生的主要病理基础。因此,如何阻止血管平滑肌增殖成为预防血管再狭窄的关键[11]。药物涂层支架的开发为有效防治血管成形术后再狭窄的发生提供了一种有效的手段,然而当前使用的抗再狭窄药物如紫杉醇、雷帕霉素等不仅价格昂贵,同时具有一定的毒性,因而还不是最为理想的支架涂层药物。所以开发副作用小,价格低廉的能有效抑制血管平滑肌细胞增殖的药物是众多学者研究的目标。
曲美他嗪是哌嗪类衍生物,为线粒体长链3-酮酰辅酶A硫解酶(3-KAT)抑制剂,主要通过抑制心肌脂肪酸氧化,增加葡萄糖氧化,改善糖酵解与糖氧化偶联,减少高能磷酸盐生成过程中对氧的需要,维持细胞内ATP浓度,从而起到心肌保护作用。近年来研究发现,曲美他嗪有抑制氧自由基、抗氧化、抗凋亡的作用。曲美他嗪作为一种细胞保护剂,不仅可以保护心肌细胞,对血管内皮细胞也起到保护作用。Dehina L等报道在急性冠状动脉缺血动物模型,曲美他嗪通过保护线粒体途径,从而起到保护心脏作用[12] 。Lin等报道PCI术前使用3天常规剂量的曲美他嗪联合阿托伐他汀钙能保护患者围手术期的心肌损伤[13] 。Wu Q等报道曲美他嗪通过抗氧化和参与Akt/eNOS信号通路的作用机制对内皮细胞起保护作用[14] 。近年来,随着对曲美他嗪药理作用的深入研究,极大地推动了其临床应用进展。若能将其应用于PCI术后再狭窄的防治,必将大
大降低RS的成本,为RS患者带来新的希望。经检索国内外文献,目前尚无丹皮酚抗血管成形术后再狭窄的相关报道。
3.拟解决的关键性问题:
本项目的立意与基本思路主要是针对丹皮酚抗RS的作用及机制研究。因此,本项目拟解决的关键问题在于内皮细胞、抗血管平滑肌细胞增殖的有效方法。另外,标准动物模型的建立也是本研究的关键,课题组成员有着丰富的动物实验经验,曾经成功建立家兔和大鼠心肌缺血、腹主动脉狭窄模型以及血管成形术后再狭窄动物模型。
参考文献:
[1] Cohen M,Antmann EM,Miurphy SA,et al:Mode and timing of treatment failures(recurrent ischemic events)after hospital admission for non-ST-segment elevation acute coronary syndromes.Am Heart I 2002;143:63-69.
[2] Boersma I,Harrington RA,Moliterno DJ,et al:Platelet glycoporotein Ⅱb/Ⅲa inhibitors in acute coronary syndromes:A meta-analysis of all major randomised clinical trials.Lancet 2002;359:189-198.
[3] Capewells S,Macintyre K,Stewart S,et al:Age,sex,and social trends in out-of –hospital deathss in Scotland 1986-1995:A retrospective cohort study.Lancet 2001;358:1213-1217.
[4] Raithel D.Complications of carotid artery stenting.J Cardiovasc Surg(Torino).2005;46(3):261-5.
[5] Sturek M,Reddy HK.New tools for prevention of restenosisi could decrease the “oculo-stent”reflex.cardiovasc res.2002;53:292-293;
[6] Bauters C,Isner JM.The biology of restenosis.prog cardiovasc,1997,40:97-106;
[7] Rivars A,Andres V.Vascular smooth muscle cell proliferation in the pathogenesis of atherosclerotic cardiovascular diseases.Histol Histopathol.2000;15(2):557-71;
[8] Zhou W, Lin PH, Bush RL,et al.Management of in-sent restenosis after carotid artery stenting in high-risk patients. J Vasc Surg.2006 Feb;43(2):305-12.
[9] Ascher E, Hingorani AP, Marks N. Duplex-assisted internal carotid artery balloon angioplasty and stent placement. Perspect Vasc Surg Endovasc Ther.2007 Mar;19(1):41-7.
[10] Tigerstedt NM,Savolainen - Peltonen H,LehtiS,et al.Vascular cell kinetics in response tointimal injury ex vivo.J Vasc Res,2010;47:35-44.
[11] Tanaka K,Sata M. Contribution of circulating vascular progenitors in lesion formation and vascular healing: lessons from animal models.Curr OpinLipidol,2008;19: 498-504.
[12] Dehina L, Vaillant F, Tabib Aet al;Trimetazidine demonstrated cardioprotective effects through mitochondrial pathway in a model of acute coronary ischemia.Naunyn Schmiedebergs Arch harmacol.2013 Mar;386(3):205-15.
[13] Lin X1, Ma A2, Zhang W3, et al;Cardioprotective Effects of Atorvastatin plus Trimetazidine in Percutaneous Coronary Intervention.Pak J Med Sci.2013 Apr;29(2):545-8.
[14] Wu Q, Qi B, Liu Y,et al;Mechanisms underlying protective effects of trimetazidine on endothelial progenitor cells biological functions against H2O2-induced injury: involvement of antioxidation and Akt/eNOS signaling
二、研究目标与研究内容
1.研究开发目标:
①、通过检测曲美他嗪体外对人脐动脉血管平滑肌细胞增殖的影响;
②、分析曲美他嗪体内PCI术后再狭窄的作用;
③、利用基因芯片技术研究曲美他嗪抗RS的分子机制;
④、为最终将曲美他嗪应用于RS的防治提供理论依据。
2.科学研究内容:
①、曲美他嗪体外对人脐动脉血管平滑肌细胞增殖的影响:
培养人脐动脉血管平滑肌细胞(USMC),用不同浓度的曲美他嗪进行处理,MTT法检测曲美他嗪作用后USMC的增殖率,流式细胞仪检测曲美他嗪作用后的细胞周期的变化。
②、曲美他嗪体内抗PCI术后再狭窄的作用研究:
建立家兔腹主动脉狭窄模型,术后给予高脂饮食继续饲养4周。在数字减影机下,对腹主动脉狭窄模型家兔狭窄段血管行球囊扩张术,然后分别注射不同浓度的曲美他嗪,定期DSA检查颈动脉狭窄程度,HE染色和Masson染色观察动脉内膜增生厚度和狭窄动脉的大体形态学改变。血管特殊染色观察I型胶原增生,图像分析系统测定新生内膜面积。同时将结果与他汀类药物进行比较。免疫组化染色检测曲美他嗪处理前后兔狭窄段动脉增殖细胞核抗原(PCNA)表达水平的变化。
③、曲美他嗪抗RS的分子机制研究:
利用基因芯片技术检测曲美他嗪处理前后兔狭窄段血管基因表达谱的变化,探讨曲美他嗪抗RS的可能分子机制。
三、研究方案(包括研究对象、研究方法、技术路线、统计方法等)
1) 实验方案:
①、人脐动脉血管平滑肌细胞的体外培养:
无菌条件下去胎儿脐带,按Ross贴片法,用含100ml/L新生胎牛血清、碱性成纤维生长因子(bFGF)和表皮生长因子(EGF)的DMEM培养液培养VSMC。
②、曲美他嗪对USMC体外增殖的影响:
用不同浓度的曲美他嗪处理体外培养的USMC,MTT法检测曲美他嗪作用后USMC的增殖率,流式细胞仪检测曲美他嗪作用后的细胞周期的变化。同时与他汀类药物相比较。
③、家兔腹主动脉狭窄模型的建立:
在血管造影机下行腹主动脉造影术,行选择性腹主动脉造影。并置入3F球囊导管插至胸主动脉,并充压拉剥脱内皮,造成血管损伤。术后给予高脂饮食4周。
①、曲美他嗪体内抗PCI术后再狭窄的作用研究:
在血管造影机下,将球囊送入腹主动脉的狭窄血管处,向球囊注水扩张血管造成支架成形术样损伤,然后分别于动脉腹腔注射不同浓度的曲美他嗪,定期进行血管造影(DSA)检查腹主动脉狭窄程度,于不同时段处死动物,以腹主动脉为中心,制作石蜡切片,HE染色和Masson染色观察动脉内膜增生厚度和狭窄动脉的大体形态学改变。血管特殊染色观察I型胶原增生,图像分析系统测定新生内膜面积。同时将结果与紫杉醇、他汀类药物进行比较。免疫组化染色检测曲美他嗪处理前后兔狭窄段动脉增殖细胞核抗原(PCNA)表达水平的变化。
②、曲美他嗪抗RS的分子机制研究:
分别取处理前后腹主动脉血管,置于低温冰箱保存,抽提总RNA,然后与基因芯片杂交,分析处理前后兔狭窄段血管基因表达谱的变化,探讨曲美他嗪抗RS的可能分子机制。
(2)技术路线图:
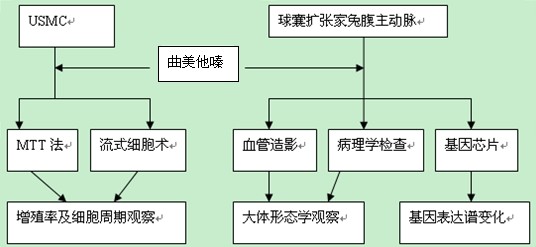
(3)统计学方法:
采用SPSS16.0统计软件分析,计量资料以均数±标准差表示,多组样本均数比较先进行方差齐性检验,组间比较用单因素方差分析(ANOVA)。方差齐者两两比较采用LSD法检验,方差不齐者两两比较采用Dunnett's T3检验。当P<0.05为差异有统计学意义,P>0.05为差异无统计学意义。