消化在线: 夏冰 蛋白酪氨酸磷酸酶非受体型22基
来源:
蛋白酪氨酸磷酸酶非受体型22基因rs2488457位点多态性
与溃疡性结肠炎的相关性
陈志涛, 吴 杰, 王 萍, 张 姮, 夏 冰, 黄晓东
陈志涛, 吴杰, 王萍, 张姮, 黄晓东, 武汉市中心医院消化内科 武汉市中心医院中心实验室 湖北省武汉市 430014
夏冰, 武汉大学中南医院消化内科 湖北省医学肠病临床研究中心 湖北省过敏与免疫相关疾病重点实验室 湖北省武汉市 430071
陈志涛, 消化内科博士, 武汉市中心医院消化内科主治医师, 主要从事炎症性肠病的遗传免疫学研究.武汉市卫生局基金资助项目, No. WX12C34
作者贡献分布: 此课题的设计与写作由陈志涛与吴杰完成; 标本采集由陈志涛、王萍及黄晓东完成; 研究过程由陈志涛与张姮完成; 数据分析由陈志涛、吴杰及夏冰完成.
摘要
目的: 本实验探讨蛋白酪氨酸磷酸酶非受体型22基因(protein tyrosine phosphatase nonreceptor type 22, PTPN22 )启动子区-1123G/C及外显子10区+788G/A 多态性与湖北汉族溃疡性结肠炎(ulcerative colitis,UC)的相关性,研究UC患者肠黏膜PTPN22 mRNA表达。
方法:收集165例UC患者和300名健康对照者,采用聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)方法检测PTPN22 基因-1123G/C和+788G/A位点多态性. 实时定量PCR方法测定肠黏膜PTPN22 mRNA表达.
结果: UC患者PTPN22 基因-1123G/C位点“CC+CG”基因型和C等位基因频率显著高于正常对照组(66.7%vs 53.3%,P = 0.005, OR= 1.75, 95%CI: 1.18-2.60; 41.5% vs 33.5%, P =0.015, OR =1.41, 95%CI: 1.07-1.86), 且与广泛性结肠炎相关(P = 0.029). 与缓解期UC患者比, 活动期UC患者肠黏膜PTPN22 mRNA的水平显著增高(P = 0.005). UC患者PTPN22基因-1123G/C基因型与肠黏膜PTPN22 mRNA的水平无关. UC组+788G/A基因型频率与对照组比, 差异无统计学意义.
结论: PTPN22基因启动子区-1123G/C位点C等位基因频率与湖北汉族UC相关, 活动期UC患者肠黏膜PTPN22 mRNA水平增高, 提示PTPN22 基因在UC遗传免疫发病机制中可能起重要作用.
关键词: 蛋白酪氨酸磷酸酶非受体型22基因; 溃疡性结肠炎; 多态性; 表达
核心提示: 蛋白酪氨酸磷酸酶非受体型22(protein tyrosine phosphatase nonreceptor type 22, PTPN22 )基因启动子区-1123G/C位点C等位基因与湖北汉族UC相关, 活动性溃疡性结肠炎(ulcerative colitis, UC)患者肠黏膜PTPN22 mRNA水平增高,提示PTPN22基因在UC遗传免疫发病机制中可能起重要作用。
引言
溃疡性结肠炎(ulcerative colitis, UC)是一种病因不明的慢性肠道炎性疾病, 病变主要累及肠道黏膜层及黏膜下层. 临床表现为黏液脓血便、腹痛、腹泻甚至癌变等, 病情轻重不等, 反复发作, 难以治愈, 严重影响患者生活质量. 研究提示UC发病机制可能为遗传与环境等综合作用,致使肠黏膜免疫反应过高所致, 其中T细胞过度活化起重要作用[1]. 蛋白酪氨酸磷酸酶非受体型22基因(protein tyrosine phosphatase nonrecep-tor type 22, PTPN22 )定位于人染色体1p13, 编码淋巴特异性酪氨酸磷酸酶(lymphoid tyrosine phosphatase, LYP). LYP属于酪氨酸磷酸酶家族,在T细胞胞内表达, T细胞激活后, LYP通过与酪氨酸激酶CSK的SH3结构域结合, 使已磷酸化的SCK家族Lck、Fyn和Zap-70激酶脱磷酸化, 抑制T细胞信号转导, 下调T细胞活化, 具有免疫抑制作用和抗炎作用[2,3]. 多数研究提示PTPN22基因多态性与多种自身免疫性疾病相关[4]. 显示PTPN22 基因启动子区-1123G/C多态性与I型糖尿病、类风湿性关节炎相关, 且提示该基因多态性可以影响PTPN22 mRNA表达水平[5,6]. 近来研究发现PTPN22基因外显子10区+788G/A多态性与欧美UC显著相关[7]. 然而至今鲜见PTPN22基因与我国UC遗传易感性的研究报道. 本文旨在探讨PTPN22基因启动子区-1123G/C和外显子10区+788G/A多态性与UC的相关性, 检测PTPN22 mRNA在UC患者肠黏膜中的表达状况
及其与PTPN22基因多态性的关系.
1 材料和方法
1.1 材料 收集武汉市中心医院及武汉市其他大型综合医院2005-01/2012-08期间的UC患者165例, 男95例(57.6%), 女70例(42.4%), 平均年龄41.3岁±13.5岁, 经临床、实验室、放射学、内镜及组织学检查综合诊断. 诊断标准参考中华医学会消化病学分会“对我国炎症性肠病诊断治疗规范的共识意见”制定[8]. 所有UC患者的临床资料均登记注册, 有完整的结肠镜和病理学资料. 其中直肠炎55例(33.3%), 左半结肠炎62例(37.6%), 广泛型结肠炎48例(29.1%); 24例患者有肠外表现(14.5%); 有1例患者(0.6%)行结肠切除. 其中57例UC患者被随机纳入PTPN22 mRNA的表达研究.
正常对照者300例, 男165例(55.0%), 女135例(45.0%), 平均年龄43.7岁±11.2岁, 来自
2005-01/2012-08期间于武汉市中心医院的健康体检者, 均无炎症性肠病、肠道肿瘤及其他自身免疫性疾病史. 所有受试对象均签署知情同意书.
1.2 方法
1.2.1 模板DNA制备: 采集UC患者和正常对照者外周静脉血2 mL(EDTA抗凝), 用Qiagen DNA提取试剂盒(德国QIAGEN公司)提取人血白细胞基因组DNA.1 . 2 . 2 P T P N 2 2 基因启动子区 - 1 1 2 3 G / C(rs2488457)和外显子10区+788G/A(rs33996649)多态性检测: 采用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism, PCR-RELP)方法检测rs2488457和rs33996649位点多态性. (1)包括-1123G/C和+788G/A位点基因片段扩增: PCR引物序列如下[9], -1123G/C位点: 上游5'-C C ATTG AGA GGT TAT GCG AGC T-3', 下游5'-CGCCAC CTT GCT GAC AAC AT-3'; +788G/A位点:上游5'-GAT GGA GCA AGA CTC AGA CAC-3',下游5'-CCC CAT GTT AGA AGA GCA GAT-3'.PCR扩增条件: 95 ℃预变性5 min, 95 ℃变性40s, 56 ℃退火40 s, 72 ℃延伸40 s, 35个循环, 最后72 ℃延伸5 min; (2)多态性分析: 向PCR产物中分别加入限制性内切酶SacⅠ和MspⅠ(Fermen-tas, Burlington, ON, Canada), 于37 ℃水浴3 h后,经2.5%琼脂糖凝胶电泳分离. 部分PCR产物经测序(北京诺赛基因组研究中心)后, 作为阳性对照用于辅助判断其他样本基因型.
1.2.3 肠黏膜标本采集: UC患者在进行结肠镜检查时, 活检取其肠黏膜组织. 其中病变活动期在炎性反应最显著处取材, 缓解期在未见炎性病变处取材, 组织标本-80 ℃保存待测.
1.2.4 总RNA提取和cDNA合成: TRIzol法抽提UC患者和对照者肠黏膜总RNA, RNA质量由吸光度值(A260/280)和甲醛变性电泳共同鉴定. 取电泳至少出现2条条带及A260/280比值在1.8以上的RNA进行下一步实验, 并统一各样本RNA浓度至0.5?g/?L. 取总RNA 1 ?g逆转录为cDNA, 具体步骤参考逆转录试剂盒说明书(美国Fermentas).
1.2.5 实时定量PCR: 采用SYBR Green实时定量PCR试剂盒(日本Takara)检测肠黏膜PTPN22
mRNA表达水平. 用?-actin作为内参照基因. 引物序列如下[10]: PTPN22 mRNA: 上游5'-TGC
CCA CCA AAC AAG CC-3', 下游5'-TGG TGGTGG ATT CCT TGG-3'; ?-actin mRNA: 上游5'-AGC CAT GTA CGT TGC TAT-3', 下游5'-CTTAAT GTC ACG CAC GAT TT-3'. 于实时定量PCR扩增仪Rotor-Gene 3000(澳大利亚)上完成扩增, 扩增条件: 95 ℃预变性10 min后, 95 ℃变性20 s, 56 ℃退火20 s, 72 ℃延伸20 s, 45个循环,最后72 ℃延伸10 min. 采用标准化后的2- -??Ct
方法,来分析目的基因PTPN22 mRNA表达[11].
统计学处理 应用统计软件SPSS 15.0进行统计学分析, P<0.05为差异有统计学意义. 频数资料采用χ2检验及Fisher's精确概率法. 为防止Ⅰ类统计学错误, 采用Bonferroni多重校正. 连续变量资料采用mean±SD表示, 组间比较采用独立样本t检验.
2 结果
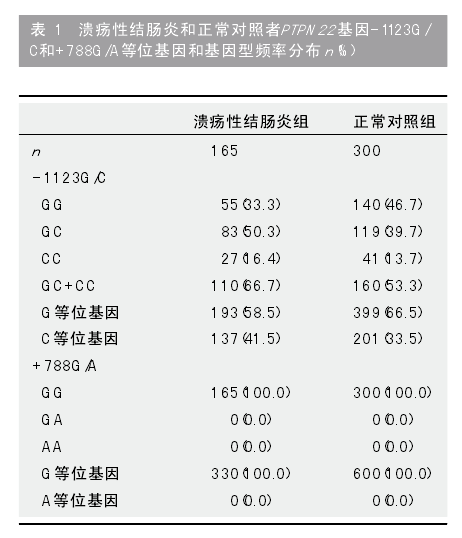
2.1 PTPN22 基因-1123G/C和+788G/A多态性分析 基因型判读: -1123G/C位点经SacⅠ消化后的酶切产物为298 bp和25 bp 2条带为GG型, 323bp、298 bp和25 bp 3条带为GC型, 323 bp 1条带为CC型, 因25 bp太小, 图中未能显示(图1).PTPN22 基因+788G/A位点经Msp Ⅰ消化后的酶切产物为143 bp和91 bp 2条带为GG型, 234 bp、143 bp和91 bp 3条带为GA型, 234 bp 1条带为AA型.经χ2检验, UC患者和正常对照者PTPN22基因-1123G/C和+788G/A基因型分布符合Hardy-Weinberg平衡规律, 结果表明所选人群具有群体代表性. UC患者性别、年龄与正常对照者相比, 差异无统计学意义(P = 0.592;P = 0.849). UC组和正常对照组中, PTPN22基因-1123G/C和+788G/A等位基因及基因型分布见表1. 与正常对照者比, UC患者-1123G/C位点C等位基因频率显著增高, 差异有统计学意义(41.5% vs 33.5%,P = 0.015, OR = 1.41, 95%CI: 1.07-1.86). UC患者-1123G/C位点“CC+CG”基因型频率亦显著高于正常对照组, 差异有统计学意义(66.7% vs53.3%, P = 0.005, OR = 1.75, 95%CI: 1.18-2.60).UC组与正常对照组+788G/A位点等位基因和基因型频率比较, 差异无统计学意义(表1).
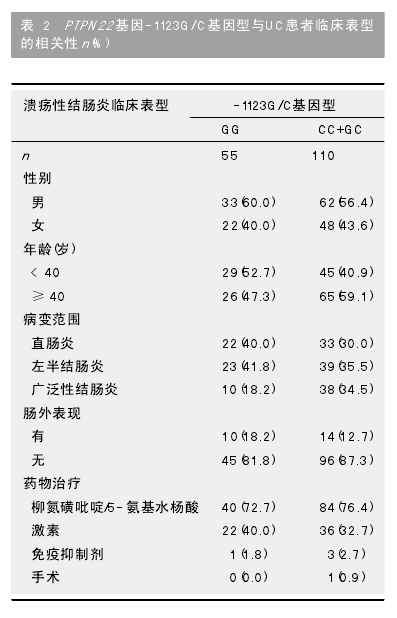
2.2 PTPN22 基因-1123G/C多态性与UC临床表型的关系 如表2所示, 在PTPN22基因-1123G/C多态性与UC患者性别、年龄、病变范围、肠外表现及治疗情况的相关分析中, 仅仅显示-1123G/C多态性与UC病变范围相关, 在UC患者中, 与GG基因型相比, “GC+CC”基因型中发生广泛性结肠炎患者频率显著增高, 差异有统计学意义(P= 0.029, OR = 2.38, 95%CI: 1.08-5.23).
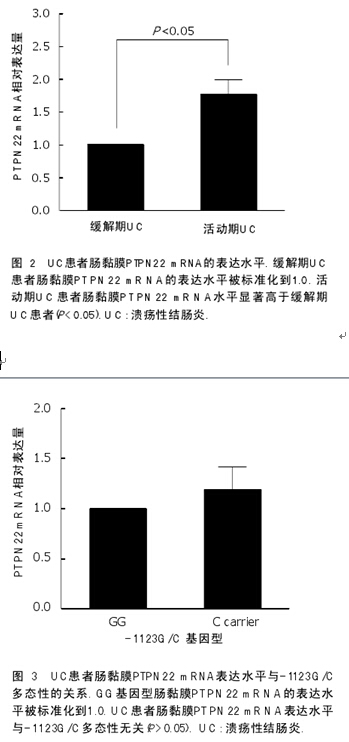
2.3 UC患者肠黏膜PTPN22 mRNA的水平 与缓解期UC患者(n = 14)比, 活动期UC患者(n = 43)肠黏膜PTPN22 mRNA水平显著增高, 差异有统计学意义(t = -5.613,P = 0.005, 图2).
2.4 U C患者肠黏膜P T P N22 m R N A水平与- 11 2 3 G / C多态性的相关性 肠黏膜 P T P N 2 2
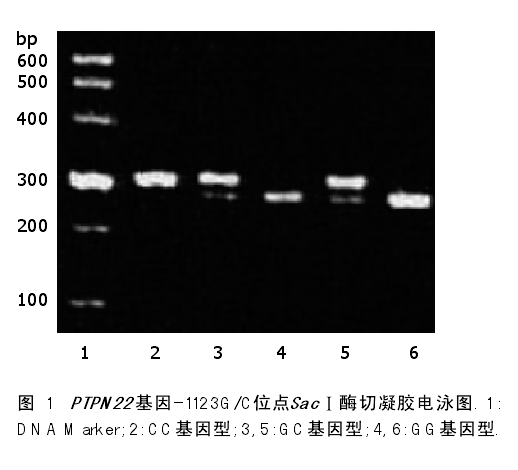
m R N A表达水平与-1123G/C多态性无关(P >0.05, 图3).
3 讨论
我们研究表明, PTPN22基因-1123G/C位点C等位基因频率与我国湖北汉族UC相关, 且UC患者中-1123G/C位点C等位基因携带者(即GC+CC基因型)频率与广泛性结肠炎相关, 而UC组与正常对照组PTPN22基因+788G/A位点等位基因和基因型频率分布无显著差别. UC患者广泛型结肠炎被认为是相对较严重的一种临床表型, 与其他病变范围相比, 广泛性结肠炎患者发生消化不良、结肠切除术甚至结肠癌的几率相对增高. 这些现象提示携带C等位基因的人群罹患UC的风险可能会增大. 研究提示, 与正常对照者比, 类风湿关节炎患者PTPN22基因-1123G/C位点C等位基因频率显著增高[12]. Liu等[6]研究显示,PTPN22 基因-1123G/C位点GC基因型频率明显高于对照者. Kawasaki等[13]研究发现PTPN22基因-1123G/C多态性与日本1型糖尿病显著相关,这些均支持我们的结论, 提示PTPN22基因可能参与UC的发病.PTPN22 基因定位于人染色体1p13,编码淋巴特异性酪氨酸磷酸酶LYP, 研究报道, LYP参与T细胞信号转导, 下调T细胞活化, 抑制T细胞介导的自身免疫反应, 是重要的T细胞活化负性调节因子[3], 而T细胞过度活化在UC发病中起重要作用, 因此PTPN22基因的异常表达可能在UC发病中起一定作用. 我们采用实时定量PCR方法检测UC患者肠黏膜PTPN22 mRNA的表达, 结果显示PTPN22 mRNA表达水平与UC疾病活动性相关, 与缓解期UC患者比,活动期UC患者肠黏膜PTPN22 mRNA表达水平显著增高. Ronninger等[14]研究报道, 在类风湿性关节炎患者中, 其外周血单个核细胞PTPN22 mRNA的表达水平明显高于正常对照者, 且另有研究显示类风湿性关节炎患者mRNA表达水平与疾病的自身抗原浓度正相关[15]. UC患者肠黏膜PTPN22 mRNA表达水平增高的具体原因不明, 可能与多种因素有关: (1)T细胞过度活化导致PTPN22 mRNA表达相应增高[3]; (2)除了T细胞,尚存在其他细胞亦可表达PTPN22蛋白[3]; (3)PTPN22 mRNA表达水平可能与遗传变异及疾病的免疫学状态相关等[2].
研究发现PTPN22基因-1123G/C位点所在的DNA序列与转录因子激活蛋白4(activated protein4, AP-4)的结合位点相匹配, 后者属螺旋-环-螺旋拉链结构家族, 结合转录因子反义链.-1123G/C位点位于AP-4结合序列的中心基序区域[16]. 为探讨启动子区多态性是否调节mRNA表达水平, 我们分析了UC患者PTPN22 基因-1123G/C位点多态性与PTPN22 mRNA表达水平的差别, 结果显示UC患者-1123G/C位点多态性与PTPN22 mRNA表达水平无关. 而Viken等[5]研究报道PTPN22基因-1123G/C多态性可以调节类风湿性关节炎患者PBMCs中PTPN22 mRNA的表达水平. 出现这种差异结果的原因可能与下列因素有关: (1)该研究中我们的样本量偏小,可能尚未达到分辨mRNA细微表达差别的检测能力; (2)PTPN22 mRNA不仅表达于T细胞, 还表达于B细胞、单核细胞及中性粒细胞等[3]. 我们所检测的PTPN22 mRNA来源于肠黏膜总RNA,而这种受基因突变调节的mRNA的表达可能仅限于某种T细胞亚群[2].
我们的研究提示PTPN22 基因启动子区-1123G/C多态性与我国湖北汉族UC相关, 且与广泛性结肠炎相关. 提示PTPN22基因可能参与UC的遗传免疫学发表机制。