钱家鸣: 钱家鸣 HRM 技术检测炎症性肠病患
来源:
HRM 技术检测炎症性肠病患者 TPMT 的基因多态性
徐 颖1,钱家鸣1,张 学2,赵秀丽2,吕 红1,刘彦山2,沈冰冰1
1. 中国医学科学院 北京协和医学院 北京协和医院消化内科,北京 100730; 2. 中国医学科学院 北京协和医学院 基础医学研究院医学遗传学系
【摘要】 目的 应用 HRM 技术检测炎症性肠病( IBD) 患者 TPMT 基因多态性,进而探索 IBD 患者 TPMT 基因型与硫唑嘌呤( AZA)致骨髓抑制的关系。方法 采用聚合酶链反应 - 高分辨熔解曲线( PCR-HRM) 与 Sanger 法序列测定相结合的方法,对 82 例 IBD 患者和 53 名健康志愿者 TPMT 基因第 7、10 外显子进行检测。结果 IBD 患者中 TPMT* 1/* 3C 杂合子 4 例,健康对照者中 TPMT*1 /* 3C 杂合子 2 例。未检测出 TPMT* 3A 和 TPMT* 3B 型突变。IBD 患者 4 例出现骨髓抑制的患者中,1 例是 TPMT* 1 / * 3C 杂合子; 其余3 例为 TPMT 野生型。结论 TPMT* 3C( A719G) 基因突变在中国的 IBD 患者中较 TPMT* 3A( G460A/A719G) 、TPMT*3B( G460A) 发生率高,而存在此基因突变的 IBD 患者对硫唑嘌呤不能耐受,导致骨髓抑制。然而 TPMT 基因突变只能解释部分AZA 治疗 IBD 导致骨髓抑制的病例。
【关键词】 炎症性肠病; 甲基转移酶类; 基因型; 硫唑嘌呤
炎症性肠病( inflammatory bowel disease,IBD) 是一组病因未明的慢性肠道疾病。治疗该病的免疫抑制剂硫唑嘌呤( AZA) 和 6-巯基嘌呤( 6-MP) 在使用过程中某些患者出现严重的骨髓抑制而使治疗终止。硫唑嘌呤甲基转移酶( TPMT) 是 AZA 和 6-MP 代谢过程中的重要酶,它的低活性会导致 AZA( 6-MP) 的一种代谢产物 6-鸟嘌呤核苷酸( 6-TGN) 的浓度过高,而 6-TGN在体内浓度过高是引起骨髓抑制的主要原因[1-2]。
TPMT 酶活性在群体中存在明显的遗传变异性。TPMT 常见突变位点是位于第 7 外显子上的 G460A 和位于第 10 外显子上的 A719G,具有上述突变的患者TPMT 酶活性下降,因此在给予 AZA 治疗之前,如能查明患者是否携带有此突变,就可以指导 AZA 的治疗用量,进而预防这些患者骨髓抑制的发生[2-4]。本研究主要针对上述 2 个突变位点所形成的突变等位基因TPMT* 3A ( G460A / A719G) 、TPMT * 3B ( G460A) 、TPMT* 3C( A719G) 进行检测。目前,对于 TPMT 的基因型测定尚无金标准[5],国内外对基因多态性的研究方法多采用 PCR-RFLP 和PCR-SSP,而本实验采用高分辨率熔解( high resolution melting,PCR-HRM) 的方法,是近年来发展起来的新技术,本实验首次将其用于 IBD 易感基因的研究。
1 对象与方法
1. 1 一般资料 收集 2004 年 7 月 - 2008 年 6 月于北京协和医院( 71 例) 及上海第一人民医院( 11 例) 就诊的 IBD 患者共82 例。诊断均符合 2001 年成都全国炎症性肠病学术研讨会制定的标准。IBD 患者共 82 例( UC 38 例、CD 42 例、IC 2 例) ,其中男 50 例,女 32例,年龄 16 ~78 岁,平均年龄( 40. 48 ±13. 46) 岁。其中有 31 例患者使用了 AZA( 剂量 50 ~100 mg/d) 进行治疗。根据是否使用硫唑嘌呤治疗将 IBD 患者分为两组: 使用硫唑嘌呤治疗组( A 组) 和未使用硫唑嘌呤组( B 组) 。A 组中有 4 例患者出现了骨髓抑制。健康对照者53 名( C 组) ,为无血缘关系的无偿献血者和健康志愿者,其中男 28 名,女 25 名,年龄 23 ~ 73 岁,平均年龄( 41. 06 ±12. 72) 岁。A 组与 C 组、B 组与 C 组年龄差异无统计学意义( P >0. 05) ,具有可比性。
1. 2 方法
1. 2. 1 DNA 提取: 采集上述人群的外周血 4 ml,使用德国 Qiagen 公司生产的 DNA 提取试剂盒: QIAampDNA Blood Minikit 进行 DNA 提取1. 2. 2 第 7、10 外显子的 PCR 扩增: 采用巢式 PCR 的方法,所提取的 DNA 进行相应片段的扩增( PCR 引物见表 1) 。在内侧片段扩增的体系中加入 LCGreen 荧光染料( 美国 Idaho Technology Inc 公司生产) 。在TP600 仪( 日本 TAKARA BIO. Inc. 公司生产) 上完成PCR。第 7 外显子外侧体系反应条件为 95 ℃ 预变性 5min,然后进行 35 次循环( 94 ℃ 变性 20 s、60 ℃ 退火20 s、72 ℃ 延伸 20 s) ,最后在 72 ℃ 延伸 8 min,置 4 ℃保存。第 7 外显子内侧体系反应条件为 95 ℃预变性3 min,然后进行 35 次循环( 94 ℃ 变性 20 s、58 ℃ 退火20 s、72 ℃ 延伸 20 s) ,最后在 72 ℃ 延伸 5min,置 4 ℃保存。第10 外显子外侧体系反应条件为 95 ℃预变性3 min,然后进行 35 次循环( 94 ℃ 变性 35 s、58 ℃ 退火60 s、72 ℃ 延伸 60 s) ,最后在 72 ℃ 延伸 8 min,置 4 ℃保存。第10 外显子内侧体系反应条件为 95 ℃预变性3 min,然后进行 35 次循环( 94 ℃ 变性 20 s、60 ℃ 退火20 s、72 ℃ 延伸 20 s) ,最后在 72 ℃ 延伸 5 min,置 4 ℃保存。
1. 2. 3 基因检测: 使用 LightScanner Instrument 96( 美国 Idaho Technology Inc. 公司生产) 对第 7、10 外显子的 PCR 产物进行 HRM 检测。取巢式 PCR 终产物 10μl 分别加入 96 孔检样板的加样孔中,将检样板放Light Scanner 中,调整好开始温度( start temp) 和终止温度( end temp) 后( 第 7 外显子和第 10 外显子的开始温度分别为 73 ℃ 及 72 ℃,终止温度分别为 88 ℃ 及84 ℃ ) ,仪器开始自动检样。
随机取经 PCR-HRM 检测后认为是杂合型和野生型及其他未知型的样本各若干例,进行 PCR-测序( 由北京诺赛基因组研究中心有限公司完成) ,以检测其真实的基因型是否与 PCR-HRM 方法检测出的基因型相符。
1. 2. 3 基因检测: 使用 LightScanner Instrument 96( 美国 Idaho Technology Inc. 公司生产) 对第 7、10 外显子的 PCR 产物进行 HRM 检测。取巢式 PCR 终产物 10μl 分别加入 96 孔检样板的加样孔中,将检样板放Light Scanner 中,调整好开始温度( start temp) 和终止温度( end temp) 后( 第 7 外显子和第 10 外显子的开始温度分别为 73 ℃ 及 72 ℃,终止温度分别为 88 ℃ 及84 ℃ ) ,仪器开始自动检样。
随机取经 PCR-HRM 检测后认为是杂合型和野生型及其他未知型的样本各若干例,进行 PCR-测序( 由北京诺赛基因组研究中心有限公司完成) ,以检测其真实的基因型是否与 PCR-HRM 方法检测出的基因型相符。

1. 3 统计学方法 采用 SPSS 17. 0 统计软件分析数据。数据资料各组组间两两比较采用 t 检验。分类资料用率表示,采用卡方检验或 Fisher 确切概率法进行组间两两比较,P <0. 05 为差异有统计学意义。
2 结果
2. 1 TMPT 基因突变检测 使用 PCR-HRM 的方法检测了上述 IBD 患者及健康对照者共 135 份 DNA 样本,其第7 外显子溶解曲线及基因分型( 见图1,表2) 。为了求证由 HRM 方法测定出的 DNA 样本的真实基因型,将上述样本中野生组和杂合组取部分样本进行测序,将未知型组的全部样本进行测序,测序结果见表 3。
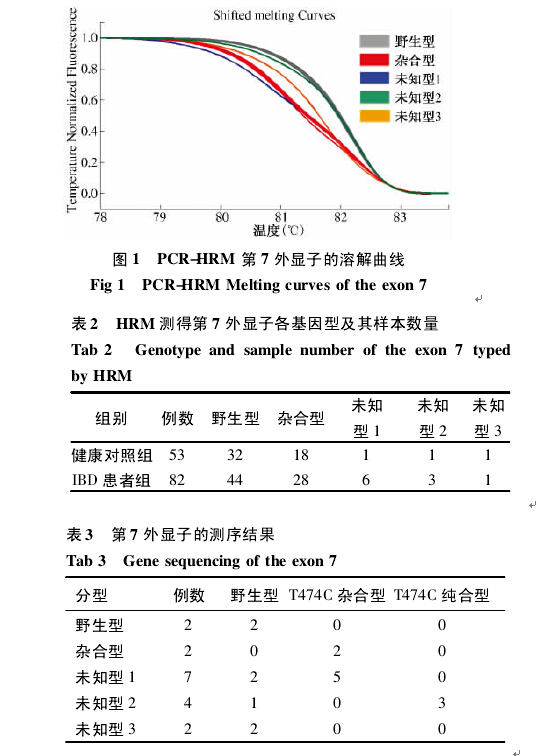
综上,本研究在第7 外显子发现了3 例 TPMT* 1S( T474C) 纯合子,51 例 TPMT* 1S( T474C) 杂合子。在第 10 外显子发现了 6 例 TPMT* 3C( A719G) 杂合子,未发现 TPMT* 3C( A719G) 纯合子。
2. 2 TPMT 基因型的分布情况 未检出有 TPMT*3A 或 TPMT* 3B 突变。TPMT * 3C ( A719G) 在 IBD患者和健康对照者中共有 6 个杂合子被检出,IBD 患者和健康对照者之间 TPMT* 3C 突变率差异无统计学意义( P >0. 05,见表 6) 。
2. 3 TPMT* 3C ( A719G) 在 A 组患者中的分布情况 在使用过 AZA 的患者( A 组) 中,有 4 例发生骨髓抑制,但仅有 1 例为 TPMT* 3C 杂合突变,其余 3 例均为野生型,野生型和突变型患者发生的骨髓抑制率差异无统计学意义( P =0. 129) 。
3 讨论
PCR-HRM 方法是近年来发展起来的新技术,HRM 技术的优势在于: ( 1) 根据 PCR-HRM 的原理,可以检测到所检测片段中可能存在的未知突变; 同样也可以针对已知突变点,设计非标记基因探针,对已知位点进行等位基因分型。( 2) PCR-HRM 是一种大通量、快速、灵敏度高、不受检测位点局限的检测突变与基因型分析方法[7]。本研究首次将其用于IBD 易感基因的研究。研究结果提示,HRM 检测出的基因型与最终的测序结果有着一定的差异。产生此差异的原因主要是 HRM 技术对于需要检测的样本( 即 PCR 产物) 质量要求高,PCR 产物质量直接决定了测定结果的准确度,可能是该方法运用于临床的局限性。但基于其优点和本研究提示,PCR-HRM 技术仍然有着广阔的应用前景。
本研究对 IBD 患者以及应用 AZA 的 IBD 患者的TPMT 酶进行了研究。TPMT 酶具有共显性遗传的特性。本研究结果提示,在第 7 外显子上检测出 T474C突变,这是一个同义突变,由于这个突变不会影响其蛋白质的合成( 异亮氨酸→异亮氨酸) ,故此突变不会影响 TPMT 酶的活性,被称为 TPMT* 1S。在第 10 外显子上无 TPMT* 3A 或 TPMT* 3B 被检出,但有 6 个TPMT* 3C ( A719G ) 杂合子被检出,占 4. 44% ( 6 /135) ,基因频率为 2. 22% ( 6 /270) 。而文献报道的亚洲人该基因频率在 0. 6% ~ 2. 54%[3,8-10]
,与本实验结果相符。IBD 患者的突变率并不显著高于健康对照者的突变率,差异无统计学意义( P >0. 05) 。本研究纳入了 31 例使用过 AZA 治疗的患者,其中有 4 例出现了骨髓抑制。在这 4 例骨髓抑制的患者中,只有 1 例是 TPMT* 3C/* 1 的杂合子。其他 3 例均为 TPMT* 1 基因野生型,且野生型和突变型患者在骨髓抑制发生率上差异无统计学意义。此结论提示,
仅凭 TPMT 基因检测作为骨髓毒性是否发生的依据是不够的。国外报道显示,TPMT 基因突变纯合型的患者在接受 AZA 常规剂量治疗时,几乎 100% 出现严重的骨髓抑制; 而杂合型患者发生严重骨髓抑制的可能性为 30% ~60%。除了受 TPMT 酶活性影响外,其他因素,如药物间的相互作用,也会引起患者出现骨髓抑制[11]。国内学者对汉族 IBD 患者进行研究后也认为,仅测定患者 TPMT 的基因型对预测骨髓抑制的发生是不全面的,而进行 TPMT 酶活性的检测有一定作用[12]。因此,对接受 AZA 或 6-MP 治疗的患者复查血常规非常重要。